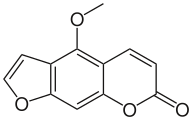
Furanokumariinit
Furanokumariinit eli furokumariinit ovat myrkyllisiä molekyylejä, joita on luontaisesti erityisesti jättiputkissa, kuten kaukasianjättiputkissa,[1] ja ruutakasveissa, kuten tuoksuruudassa.[2] Aineita on myös vähäisessä määrin ruokakasveissa, kuten persiljassa, sellerissä, palsternakassa, porkkanassa ja sitrushedelmissä.[3]


Furokumariinit ovat kolmirenkaisia yhdisteitä, joissa on furaani- ja pyronirenkaat ja näiden välissä bentseenirengas. Ne ovat psoraleenin ja angelisiinin johdannaisia.[4] Furokumariineihin kuuluvaa psoraleenia ja muita samantapaisia hiilirungoltaan suoria eli lineaarisia aineita kutsutaan usein myös psoraleeneiksi. Angelisiini ja vastaavat aineet eivät taipuneen eli angulaarisen rakenteensa vuoksi ole psoraleeneja, mutta kuuluvat furokumariineihin.[5][6]
Furokumariinit ovat kasvien ei-elintärkeitä aineenvaihduntatuotteita, joiden avulla kasvit puolustautuvat kasvinsyöjiä vastaan, koska furokumariinit ovat monille eliöille myrkyllisiä.[7] Aineet voivat UVA-valon vaikutuksesta ärsyttää ihoa. Suurina määrinä aineet vaurioittavat kudoksia vakavasti aiheuttamalla iholle palovammamaisia haavoja,[1] ja silmiin päästessään ne voivat aiheuttaa sokeutumisen.[8]
Joitakin furokumariineja käytetään lääkkeinä yhdistettynä hoitoalueen valaisuun UVA-lampulla. Aineet estävät solujen jakautumista, joten niitä voidaan käyttää hoitona psoriasikseen. Ne myös saavat ihon melanosyytit tuottamaan ihoa tummentavaa melaniinia, joten niitä on käytetty kosmeettisena hoitona vitiligoon.[9] Furokumariineja on käytetty myös ei-lääketieteellisesti ihon ruskettamista tehostavina aineina. Rusketus- ja lääkehoitoihin liittyy kuitenkin lisääntynyt ihosyöpäriski hoidetulle alueelle, koska useat furokumariinit vauroittavat solujen DNA:ta sitoutumalla siihen.[10] Ne ovat siten karsinogeenejä ja mutageenejä.[11]
Biosynteesi
[muokkaa | muokkaa wikitekstiä]

Furokumariineja muodostuu tietyissä kasveissa umbelliferonista, jota esiintyy lähes kaikissa kasveissa.[7] Umbelliferoniin liittyy dimetyyliallyylipyrofosfaatti (DMAPP) hiileen 6 tai 8 prenylaatioreaktiolla. Prenylaatio hiileen 6 tapahtuu, jos muodostuu psoraleeneja, ja hiileen 8, jos muodostuu angelisiinia tai sen johdannaisia. DMAPP kiinnittyy sitten kaksoissidoksestaan hiilen 7 hydroksyyliryhmään ja muodostaa furaanirenkaan. Muita kemiallisia muokkauksia tapahtuu erilaisten furokumariinien muodostumiseksi.[12]
Vaikutukset eliöihin
[muokkaa | muokkaa wikitekstiä]Myrkyllisyys
[muokkaa | muokkaa wikitekstiä]Furokumariinit pääsevät esimerkiksi ihokosketuksessa sisään ihon pinnan solujen tumiin, joissa ne sitoutuvat UVA-säteilyn (kuten Auringon valon) aktivoimana DNA:n juosteiden väliin. Psoraleeneihin kuuluvat furokumariinit voivat sitoa juosteet yhteen estäen siten solua lukemasta ja kopioimasta DNA:ta. Tällöin solu ei voi jatkaa normaalia toimintaansa tai jakautua ja tuhoaa itsensä ohjelmoidusti. Myös angelisiini ja sen johdannaiset sitoutuvat DNA:han ja ovat haitallisia soluille, mutta näiden sitoutuminen tapahtuu lähinnä vain yhteen juosteeseen. DNA-sitoutumisen aiheuttama laaja solutuho näkyy esimerkiksi altistusalueella nesterakkuloita sisältävänä vakavana palovammamaisena ihovaurioina.[5] Jos aineelle on altistuttu kasvin kautta, voidaan vauriosta käyttää termiä fytofotodermatiitti[13] ja muuten kattavampaa termiä fotodermatiitti eli valoihottuma.
Oireet
[muokkaa | muokkaa wikitekstiä]
Furokumariinien aiheuttamassa fytofotodermatiitissa välittömät oireet alkavat 15 minuutin kuluttua altistuksesta ja ovat voimakkaimmillaan 30–60 minuutin kuluttua. Vuorokauden kuluttua iho alkaa punertaa ja siihen kertyy turvottavia nesteitä.[15] Nämä jälkioireet ovat pahimmillaan parin päivän kuluttua,[8] ja 3–5 päivän jälkeen voi ilmetä altistusalueen ihon tummentumista (hyperpigmentaatiota). Alue voi pysyä tummana kuukausia tai jopa kuusi vuotta.[16] Alue voi olla altistuksen jälkeen vuosienkin ajan yliherkkä UV-valolle.[15] Furokumariinit vaurioittavat DNA:ta ja ovat siksi mutaatioita ja syöpää aiheuttavia, joten altistuneelle alueelle on suurentunut riski saada syöpä.[1][11]
Mekanismi
[muokkaa | muokkaa wikitekstiä]
Furokumariinit keräävät eli absorboivat helposti aallonpituusalueella 320–400 nm olevan fotonin energian, mikä johtuu aineiden rengasrakenteista, jotka ovat elektronirakenteeltaan energeettisesti otollisia tälle UVA-säteilyn absorptiolle. Energian avulla renkaiden elektronit virittyvät ja ne kiinnittyvät additioreaktiolla kovalenttisesti johonkin solun DNA-juosteiden pyrimidiiniemäksistä. Aineet kiinnittyvät lähinnä tymiinien 5,6-kaksoissidoksiin omien furaanirenkaidensa 4',5'-kaksoissidoksista tai vaihtoehtoisesti mutta vähäisemmässä määrin pyronirenkaidensa 3,4-kaksoissidoksista. Furokumariinit voivat myös kiinnittyä hyvin vähäisissä määrin sytosiiniin. RNA:ssa urasiili korvaa tymiinin, joten furokumariinit sitoutuvat RNA:ssa tymiinin sijaan helposti urasiiliin samalla tavoin.[6]

DNA:ssa kiinni olevat furokumariinit absorboivat herkästi toisenkin UVA-fotonin. Tällöin jotkin niistä kiinnittyvät vielä vapaana olevan pyroni- tai furaaniryhmänsä kaksoissidoksesta DNA-juosteen vastinemäksen kanssa. Emäs on yleensä adeniini (A), koska aineet sitoutuvat ensimmäisessä valoreaktiossaan helpoimmin tymiiniin (T). Aineet muodostavat siis kovalenttisia verkkosidoksia juosteiden välille lähinnä AT-emäsparien kohdalta. Sidokset estävät solua erottamasta DNA-juosteita toisistaan, jolloin solu ei voi lukea DNA:ta ja tuottaa sen pohjalta itselleen elintärkeitä proteiineja ja muita geenituotteita päätyen siten apoptoosiin.[17] Myös vain yhteen DNA-juosteeseen sitoutuneet furokumariinit saavat aikaan apoptoosin, mutta kahden juosteen väliset sidokset saavat tämän aikaan helpommin. Jos kuitenkin esimerkiksi solusykliä säätelevät geenit kuten p53 vaurioituvat, voi solu apoptoosin sijaan ruveta jakautumaan holtittomasti muuttuen siten syöpäsoluksi.[5]
Angelisiini ja vastaavat aineet ulottuvat sitoutumaan DNA:han lähinnä vain yhdestä kohdasta taipuneiden rakenteidensa vuoksi, toisin kuin suoran rakenteen omaavat psoraleenit. Angelisiinin johdannaiset voivat kuitenkin sitoutua samanaikaisesti molempiin juosteisiin, mutta psoraleeneja paljon vähäisemmässä määrin.[17]
Melaniinin tuotto
[muokkaa | muokkaa wikitekstiä]Furokumariinit aiheuttavat melanosyyteissä lisääntyneen melaniinin tuotannon, joten aineille altistunut ihoalue voi värjäytyä tummaksi[18] viikoiksi tai kuukausiksi. Tummentuminen alkaa pian furokumariinien aiheuttaman ihovaurion parantumisen jälkeen.[19]
Vaikutus aineenvaihduntaan
[muokkaa | muokkaa wikitekstiä]Jotkin furokumariinit vaikuttavat ihmisten aineenvaihduntaan estämällä maksan sytokromi P450 tyyppisten entsyymien toimintaa. Esimerkiksi greippimehussa olevat bergamottiini ja erityisesti 6',7'-dihydroksibergamottiini estävät muiden mehun aineiden ohella CYP3A4 toimintaa,[20] jolloin esimerkiksi runsaasti greippimehua juotaessa tällä entsyymillä toimimattomaksi hajoavien lääkeaineiden vaikutukset pitenevät tai entsyymillä toimiviksi muuttuvien lääkkeiden vaikutus heikkenee.[21]
-
Bergamottiini
-
6',7'-Dihydroksibergamottiini
Furokumariineja
[muokkaa | muokkaa wikitekstiä]Lineaarisia furokumariineja eli psoraleeneja ovat esimerkiksi bergamottiini, bergapteeni, imperatoriini, isopimpinelliini, ksantotoksoli, marmesiini (nodaketiini), metoksaleeni (ksantotoksiini), oksipeusedaniini, psoraleeni ja trioksaleeni.
-
Bergapteeni
-
Imperatoriini
-
Metoksaleeni
Angulaarisia furokumariineja ovat esimerkiksi angelisiini, apteriini ja pimpinelliini.
-
Apteriini (glykosidi)
-
Pimpinelliini
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c JC Quinn, A Kessell, LA Weston: Secondary Plant Products Causing Photosensitization in Grazing Herbivores: Their Structure, Activity and Regulation. International Journal of Molecular Sciences, 21.1.2014, 15. vsk, nro 1, s. 1441–1465. PubMed:24451131 doi:10.3390/ijms15011441 ISSN 1422-0067 Artikkelin verkkoversio.
- ↑ K Fadlalla et al.: Ruta Graveolens Extract Induces DNA Damage Pathways and Blocks Akt Activation to Inhibit Cancer Cell Proliferation and Survival. Anticancer research, tammikuu 2011, nro 1, s. 233–241. PubMed:21273604 ISSN 0250-7005 Artikkelin verkkoversio.
- ↑ R Peroutka, V Schulzová, P Botek, J Hajšlová: Analysis of furanocoumarins in vegetables (Apiaceae) and citrus fruits (Rutaceae). Journal of the Science of Food and Agriculture, 2007, 87. vsk, nro 11, s. 2152–2163. doi:10.1002/jsfa.2979 ISSN 0022-5142 Artikkelin verkkoversio.
- ↑ GP Moss, PAS Smith, D Tavernier: Glossary of class names of organic compounds and reactivity intermediates based on structure (IUPAC Recommendations 1995). Pure and Applied Chemistry, 1.1.1995, 67. vsk, nro 8-9, s. 1307–1375. doi:10.1351/pac199567081307 ISSN 1365-3075 Artikkelin verkkoversio.
- ↑ a b c FA Derheimer et al: Psoralen-Induced DNA Interstrand Cross-Links Block Transcription and Induce p53 in an Ataxia-Telangiectasia and Rad3-Related-Dependent Manner. Molecular Pharmacology, maaliskuu 2009, 75. vsk, nro 3, s. 599–607. PubMed:19064630 doi:10.1124/mol.108.051698 ISSN 0026-895X Artikkelin verkkoversio.
- ↑ a b GD Cimin et al.: Psoralens as photoactive probes of nucleic acid structure and function: organic chemistry, photochemistry, and biochemistry. Annual Review of Biochemistry, 1985, nro 54, s. 1151–1193. PubMed:2411210 doi:10.1146/annurev.bi.54.070185.005443 ISSN 0066-4154 Artikkelin verkkoversio.[vanhentunut linkki]
- ↑ a b A Dugrand-Judek et al.: The Distribution of Coumarins and Furanocoumarins in Citrus Species Closely Matches Citrus Phylogeny and Reflects the Organization of Biosynthetic Pathways. PLoS ONE, 11.11.2015, 10. vsk, nro 11. PubMed:26558757 doi:10.1371/journal.pone.0142757 ISSN 1932-6203 Artikkelin verkkoversio.
- ↑ a b K Pfurtscheller, M Trop: Phototoxic Plant Burns: Report of a Case and Review of Topical Wound Treatment in Children. Pediatric Dermatology, marraskuu 2014, 31. vsk, nro 6, s. e156–e159. PubMed:25424227 doi:10.1111/pde.12396 ISSN 0736-8046 Artikkelin verkkoversio.
- ↑ F Conforti et al.: Natural and Synthetic Furanocoumarins as Treatment for Vitiligo and Psoriasis. Current Drug Therapy, 1.1.2009, 4. vsk, nro 1, s. 38–58. doi:10.2174/157488509787081886 ISSN 1574-8855 Artikkelin verkkoversio.
- ↑ S Wu et al.: Citrus Consumption and Risk of Cutaneous Malignant Melanoma. Journal of Clinical Oncology, 10.8.2015, 33. vsk, nro 23, s. 2500–2508. PubMed:26124488 doi:10.1200/JCO.2014.57.4111 ISSN 0732-183X Artikkelin verkkoversio.
- ↑ a b S Wu et al.: Citrus consumption and risk of basal cell carcinoma and squamous cell carcinoma of the skin. Carcinogenesis, lokakuu 2015, 36. vsk, nro 10, s. 1162–1168. PubMed:26224304 doi:10.1093/carcin/bgv109 ISSN 0143-3334 Artikkelin verkkoversio.
- ↑ a b R Larbat et al.: Isolation and functional characterization of CYP71AJ4 encoding for the first P450 monooxygenase of angular furanocoumarin biosynthesis. The Journal of Biological Chemistry, 20.2.2009, 284. vsk, nro 8, s. 4776–4785. PubMed:19098286 doi:10.1074/jbc.M807351200 ISSN 0021-9258 Artikkelin verkkoversio.
- ↑ M Hannuksela: Fytofotodermatiitti (auringon ja kasvien kemikaalien aiheuttama ihottuma) Duodecim - Terveyskirjasto. Arkistoitu 15.7.2018. Viitattu 18.7.2018.
- ↑ A Hankinson, B Lloyd, R Alweis: Lime-induced phytophotodermatitis. Journal of Community Hospital Internal Medicine Perspectives, 29.9.2014, 4. vsk, nro 4. PubMed:25317269 doi:10.3402/jchimp.v4.25090 ISSN 2000-9666 Artikkelin verkkoversio.
- ↑ a b Heracleum mantegazzianum, Heracleum sosnowskyi and Heracleum persicum. EPPO Bulletin, joulukuu 2009, nro 3, s. 489–499. doi:10.1111/j.1365-2338.2009.02313.x ISSN 0250-8052 Artikkelin verkkoversio.
- ↑ Heracleum mantegazzianum www.iucngisd.org. Arkistoitu 28.8.2016. Viitattu 18.7.2018.
- ↑ a b AV Perera et al.: Cho Endonuclease Functions during DNA Interstrand Cross-Link Repair in Escherichia coli. Journal of Bacteriology, 21.10.2016, 198. vsk, nro 22, s. 3099–3108. PubMed:27573016 doi:10.1128/JB.00509-16 ISSN 0021-9193 Artikkelin verkkoversio.
- ↑ C Niu, L Yin, HA Aisa: Novel Furocoumarin Derivatives Stimulate Melanogenesis in B16 Melanoma Cells by Up-Regulation of MITF and TYR Family via Akt/GSK3β/β-Catenin Signaling Pathways. International Journal of Molecular Sciences, 6.3.2018, 19. vsk, nro 3. PubMed:29509689 doi:10.3390/ijms19030746 ISSN 1422-0067 Artikkelin verkkoversio.
- ↑ Jamie Harshman, Yi Quan, Diana Hsiang: Phytophotodermatitis. Canadian Family Physician, joulukuu 2017, 63. vsk, nro 12, s. 938–940. PubMed:29237634 ISSN 0008-350X Artikkelin verkkoversio.
- ↑ SM Kakar et al.: 6'7'-Dihydroxybergamottin contributes to the grapefruit juice effect. Clinical Pharmacology and Therapeutics, kesäkuu 2004, 75. vsk, nro 6, s. 569–579. PubMed:15179411 doi:10.1016/j.clpt.2004.02.007 ISSN 0009-9236 Artikkelin verkkoversio.
- ↑ Consumer Updates - Grapefruit Juice and Some Drugs Don't Mix www.fda.gov. Arkistoitu 23.4.2018. Viitattu 18.7.2018.