Happo-emäsreaktio

Happo-emäsreaktio eli protolyysi on kemiallinen reaktio, joka tapahtuu hapon ja emäksen välillä. Yleensä sillä tarkoitetaan reaktiota, jossa happo luovuttaa vetyionin eli protonin ja emäs vastaanottaa sen.
Esimerkiksi suolahappo protolysoituu vesiliuoksessa seuraavasti luovuttaen vesimolekyylille protonin, jolloin syntyy positiivinen oksoniumioni ja negatiivinen kloridi-ioni:
- HCl (l) + H2O (l) H3O+ (aq)+ Cl- (aq)
Reaktioyhtälön vasemmalla puolella happona toimii HCl ja emäksenä vesi. Reaktioyhtälön oikealla puolella taas oksoniumioni on happo ja kloridi-ioni emäs (vetykloridin konjugaattiemäs).
Kaikki hapot eivät protolysoidu yhtä helposti. Heikot ja vahvat hapot erotetaankin sen perusteella, kuinka helposti ne luovuttavat protonin emäkselle. Ainoa täydellisesti protolysoituva happo on perkloorihappo (HClO4). Käytännössä vahvojen happojen, kuten suolahapon (HCl) ja typpihapon (HNO3), katsotaan kuitenkin protolysoituvan vesiliuoksissaan täydellisesti.
Happo-emästeoriat
[muokkaa | muokkaa wikitekstiä]Hapoille ja emäksille on olemassa useita, eri teorioihin liittyviä määritelmiä, jotka täydentävät toisiaan. Keskeisin näistä on Brønstedin (Brønsted–Lowry) teoria, vanhin yhä käytössä olevista Arrheniuksen teoria ja niitä laajentaa Lewisin teoria.
Ennen Arrheniusta
[muokkaa | muokkaa wikitekstiä]Jo keskiajan alkemistit tunnistivat hapot erityiseksi aineryhmäksi niille tyypillisen happaman maun perusteella. Vuonna 1683 Robert Boyle määritteli hapot aineiksi, joilla on hapan maku ja joiden vaikutuksesta lakmus muuttuu punaiseksi.[1] Samalla hän nimitti alkaleiksi aineet, jotka palauttavat lakmukselle sen sinisen värin.
Happo-emäs-reaktion käsitteen esitti ensimmäisenä vuonna 1754 Guillaume-François Rouelle, joka myös otti ensimmäisenä käyttöön emästä tarkoittavan sanan base[note 1]. Sillä hän tarkoitti aineita, jotka reagoivat happojen kanssa muodostaen kiinteitä aineita, suoloja.[1] Emäksille tyypillistä on myös kitkerä maku.[2]
Lavoisier'n happoteoria
[muokkaa | muokkaa wikitekstiä]Ensimmäisen tieteellisen määritelmän hapoille ja emäksille esitti Lavoisier noin vuonna 1776. Koska hän tunsi vahvoista hapoista lähinnä vain eräät happihapot kuten typpihapon (HNO3) ja rikkihapon (H2SO4), joissa nykyisin tiedetään olevan korkean hapetusasteen saanut keskusatomi happiatomien ympäröimänä, kun taas vetyhalidien kuten vetykloridin (suolahappo, HCl), vetybromidin (HBr) ja vetyjodidin (HI) koostumusta hän ei ollut onnistunut selvittämään, hän päätyi käsitykseen, että kaikki hapot sisältävät happea.[3] Itse asiassa hän antoi hapelle nimenkin, oxgygenium, jonka hän muodosti kreikan sanoista οξυς (oxys, hapan tai terävä) ja γεινομαι (geinomai, synnyttää), siis "hapon synnyttäjä". Tämä nimi on yhä sellaisenaan tai vain vähän muuntuneena käytössä monissa kielissä, ja myös suomen kielen sana happi viittaa tämän alkuaineen esiintymiseen hapoissa.[3]
Lavoisier'n käsitys oli vallalla yli 30 vuotta, kunnes Humphry Davy eräässä vuonna 1810 julkaisemassaan artikkelissa ja sen jälkeen pitämillään luennoilla osoitti, että rikkivety (H2S), telluurivety (H2Te) ja vetyhalidit eivät happoluonteestaan huolimatta sisällä happea. Davy ei kuitenkaan onnistunut kehittämään uutta teoriaa, vaan päätyi toteamukseen, ettei happamuus ei riipu mistään tietystä alkuaineesta, vaan se on pelkästään yhdisteiden ominaisuus.[4] Jöns Jacob Berzelius teki jyrkän eron happi- ja vetyhappojen välillä[5] ja selitti, että happihapot ovat epämetallien, emäkset taas metallien oksideja.
Liebigin happojen vetyteoria
[muokkaa | muokkaa wikitekstiä]Vuonna 1838 Justus von Liebig esitti, että hapot ovat vetyä sisältäviä yhdisteitä, joiden vety voidaan korvata metalleilla.[6] Tähän käsitykseen hän päätyi tutkittuaan tarkoin orgaanisia happoja. Toisin sanoen vety, ei happi, on kaikille hapoille yhteinen ainesosa. Tästä kuitenkin seurasi, että ns. happamet oksidit kuten hiilidioksidi (CO2), rikkidioksidi (SO2) ja fosforipentoksidi (P2O5), eivät sellaisenaan ole happoja, joina Lavoisier oli niitä pitänyt[5], vaan ne muodostavat happoja vasta reagoidessaan veden kanssa. Ne ovat siis happojen anhydridejä[5]: esimerkiksi hiilidioksidi on hiilihapon (H2CO3) anhydridi, joka reagoi veden kanssa seuraavasti: CO2 + H2O → H2CO3.
Vaikka Liebigin määritelmä oli puhtaasti empiirinen, se oli vallitsevana lähes 50 vuotta, kunnes Arrheniuksen määritelmä tuli tunnetuksi.[7]
Arrheniuksen teoria
[muokkaa | muokkaa wikitekstiä]
Svante Arrhenius esitti vuonna 1884 elektrolyyttien dissosiaatioteorian, johon liittyi myös uusi happojen ja emästen määritelmä. Teorian mukaan hapot, emäkset ja suolat jakautuvat vesiliuoksissa positiivisesti ja negatiivisesti sähköisiksi ioneiksi siten, että positiivisena ionina on metalli tai vety, negatiivisena hydroksidiryhmä (OH-) tai happotähde.[8]
Jo 1800-luvun alussa tunnettiin elektrolyysi, ilmiö, jossa eräät nestemäiset tai liuenneet aineet, elektrolyytit, hajoavat kemiallisesti niiden läpi johdetun sähkövirran vaikutuksesta. Jo ennen Arrheniusta oli oletettu, että sähkövirta hajottaa tällaisten aineiden molekyylit positiivisesti ja negatiivisesti sähköisiksi ioneiksi, jotka sitten vaeltavat elektrodeihin.[9] Uutta Arrheniuksen teoriassa oli se, että elektrolyytit ovat liuoksissa ainakin osittain ioneina silloinkin, kun sähkövirtaa ei kulje[9] ja että juuri happoliuoksissa esiintyvät vetyionit ja vastaavasti emästen liuoksissa esiintyvät hydroksidi-ionit aiheuttavat toisaalta kaikille hapoille, toisaalta kaikille emäksille yhteiset ominaisuudet.[10]
Arrheniuksen teorian mukaan happo on aine, joka muodostaa vesiliuoksessa vetyioneja H+, kun taas emäs on aine, joka muodostaa vesiliuoksessa hydroksidi-ioneja OH−. Tämän teorian mukaan emäksiä ovat varsinkin alkalimetallien ja maa-alkalimetallien vesiliukoiset hydroksidit kuten natriumhydroksidi (NaOH). Teorian mukaan mukaan hapot ja emäkset reagoivat keskenään niin, että hapon vetyioni ja emäksen hydroksidi-ioni yhdistyvät vesimolekyyliksi:
- H+ + OH- H2O.
Samalla hapossa oleva negatiivinen happotähdeioni ja emäksessä oleva positiivinen ioni, tavallisimmin metalli-ioni muodostavat suolan. Suola voi laadustaan riippuen saostua tai jäädä liuenneena veteen, josta se voidaan kiteyttää haihduttamalla liuos. Esimerkiksi suolahapon ja natriumhydroksidin välinen reaktio, jossa syntyy natriumkloridia eli ruokasuolaa ja joka aikaisemmin olisi kirjoitettu:
- HCl + NaCl NaCl + H2O
voitiin nyt kirjoittaa muotoon
- H+ + Cl- + Na+ + OH- Na+ + Cl- + H2O
tai lyhemmin
- H+ + OH- H2O.
Tätä hapon ja emäksen välistä reaktiota sanotaan neutraloitumiseksi. Teoriastaan Arrhenius sai Nobelin fysiikanpalkinnon vuonna 1903.
Myöhemmin kuitenkin ilmeni, että happoliuoksissa vetyionit (H+) eivät esiinny vapaina vaan ne sitoutuvat vesimolekyyleihin muodostaen oksoniumioneja (H3O+).[10]
Ammoniakin (NH3) vesiliuoksen emäksisyyden selittämiseksi Arrheniuksen teoriassa oletettiin, että osa ammoniakista reagoi veden kanssa muodostaen ammoniumhydroksidia (NH4OH), joka sitten jakautuu muiden emästen tavoin NH4+- ja OH--ioneiksi. Ammoniumhydroksidi oli kuitenkin pelkästään hypoteettinen yhdiste, jota ei sellaisenaan ole voitu eristää, vaikka tunnetaankin useita suoloja, joissa ammoniumioni NH4+ on positiivisena ionina.[9]
Brønstedin ja Lowryn teoria
[muokkaa | muokkaa wikitekstiä]Arrheniuksen teoria koskee vain vesiliuoksia. Teorian mukaisille happo-emäs-reaktiolle analogisia reaktioita esiintyy kuitenkin myös muissa liuottimissa. Tämän vuoksi Brønsted ja Lowry vuonna 1923 toisistaan riippumatta esittivät hapoille ja emäksille uudet määritelmät.[1]
Brønsted–Lowryn happo-emästeorian mukaan happo on aine, joka luovuttaa vetyionin H+ eli |protonin, kun taas emäs on aine, joka vastaanottaa protonin. Emäksellä on vapaa elektronipari, jolla se voi sitoa protonin.[11] Brønsted–Lowryn teoriaa voidaan sellaisenaan soveltaa myös muihin kuin vesiliuoksiin.
Brønsted–Lowryn reaktio on protoninsiirtoreaktio, joka päättyy tasapainoon. Tasapainovakion arvo kuvaa hapon ja emäksen vahvuutta, ja sen avulla määritellään kunkin hapon happovakio ja emäksen emäsvakio.
Brønsted–Lowryn teoriassa ei metallihydroksideja, kuten NaOH, sellaisenaan pidetä emäksenä, vaan ainoastaan niissä oleva hydroksidi-ioni (OH−) on emäs.[12] Toisaalta tämän teorian mukaan vesikin on sekä happo että emäs, joskin kumpanakin hyvin heikko.[12]

Kun emäs (B:) vastaanottaa protonin, syntyy sitä vastaava konjugaattihappo (BH) ja alkuperäisestä haposta (HA) jää jäljelle konjugaattiemäs (A:-). Esimerkiksi hydroksidi-ionia (OH−) vastaava konjugoitunut happo on vesi (H2O), kun taas ammoniakkia (NH3) vastaava konjugoitunut happo on ammoniumioni (NH4+). Esimerkiksi suolahapon ja veden välinen reaktio tapahtuu seuraavasti:
- H2O + HCl H3O+ + Cl-,
ammoniakin ja veden välinen reaktio taas seuraavasti:
- NH3 + H2O NH4+ + OH-.
Edellisessä reaktiossa vesi toimii emäksenä vastaanottaen protonin suolahapolta, jälkimmäisessä taas happona luovuttaen protonin ammoniakille.
Lewisin teoria
[muokkaa | muokkaa wikitekstiä]
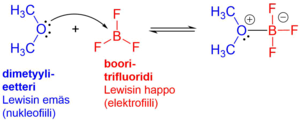
Lewisin happo-emäs-teoria määrittelee happo ja emäs -käsitteet Brønsted–Lowryn teoriaa laajemmin. Lewisin emäs (B:-) on yhdiste, joka voi luovuttaa elektroniparin[13]. Vastakohtana Lewisin happo (A+) on yhdiste, joka kykenee vastaanottamaan elektroniparin. Esim. vetykloridin protoni (H+) on Lewisin happo, koska se vastaanottaa elektroniparin tyhjälle 1s orbitaalille reagoidessaan emäksen (esim. veden) kanssa. Yleensä termiä Lewis-emäs käytetään vain niistä Lewisin teorian mukaisista emäksistä, jotka eivät ole Brønsted-emäksiä, kuten eettereistä. Molekyyliä tai ionia, joka luovuttaa vapaan elektroniparin uuden kovalenttisen sidoksen muodostamiseksi, kutsutaan nukleofiiliksi. Nukleofiili on siis sama kuin Lewisin emäs. Vastaavasti molekyyli tai ionia, joka vastaanottaa elektroniparin uuden kovalenttisen sidoksen muodostamiseksi, kutsutaan elektrofiiliksi. Elektrofiili on siis sama kuin Lewisin happo.[14] Lewisin määritelmässä mitä tahansa atomia, jolla on positiivinen varaus, osittainen positiivinen varaus tai vajaa valenssikuori, pidetään Lewisin happona. Siten esimerkiksi metalli-ionit, kuten Zn2+, Ca2+ ja Mg2+, ovat Lewisin happoja. Myös polaarisissa sidoksissa olevat atomit voivat olla Lewisin happoja tai emäksiä. Esimerkiksi karbonyyliryhmässä (C=O) oleva hiili on Lewisin happo. Myös kolmannen ryhmän alkuaineet yhdisteissä, joissa on vajaa oktetti, esimerkiksi booritrifluoridin (BF3) booriatomi, on Lewisin happo. Booritrifluoridi voi ottaa vastaan elektroniparin, jolloin reaktiossa syntyy koordinaatiosidos (kovalenttisen sidoksen erikoismuoto), jossa sidoksen muodostava elektronipari on peräisin Lewisin emäkseltä esimerkiksi eetterin hapelta.
Katso myös
[muokkaa | muokkaa wikitekstiä]
Huomautukset
[muokkaa | muokkaa wikitekstiä]- ↑ ''Base on "perustaa" tarkoittava ranskan sana, joka on lainattu myös englantiin; esiintyy nykyisin myös emästä tarkoittavana kemian terminä sekä ranskassa että englannissa.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c ”Hapot ja emäkset”, Otavan suuri ensyklopedia, 2. osa (Cid–Harvey), s. 1605. Otava, 1977. ISBN 951-1-04170-3
- ↑ William B. Jensen: The origin of the term "base". The Journal of Chemical Education, 2006, 83. vsk, nro 8. doi:10.1021/ed083p1130 Bibcode:2006JChEd..83.1130J
- ↑ a b ”Happi”, Iso tietosanakirja, 4. osa (Gottlund–Ihmels), s. 402. Otava, 1932.
- ↑ Norris F. Hall: Systems of Acids and Bases. Journal of Chemical Education, maaliskuu 1940, 17. vsk, nro 3, s. 124–128. doi:10.1021/ed017p124 Bibcode:1940JChEd..17..124H
- ↑ a b c Edvard Hjelt: ”Hapot”, Tietosanakirja, 3. osa (Haggard–Kaiverrus), s. 118. Tietosanakirja Oy, 1911. Teoksen verkkoversio.
- ↑ G. L. Messler, D. A. Tarr: Inorganic Chemistry, s. 156, 166. Määritä julkaisija!
- ↑ H. L. Finston, A. C. Rychtman: A New View of Current Acid-Base Theories, s. 140–146. New York: John Wiley & Sons, 1983.
- ↑ Yrjö Karilas: ”Kemia: Kemiallisia lakeja”, Pikku jättiläinen, s. 748. WSOY, 1964.
- ↑ a b c John Hudson: ”Liuosten kemia”, Suurin tiede: Kemian historia, s. 325–329. Suomentanut Kimmo Pietiläinen. Art House, 1995. ISBN 951-8-84171-3
- ↑ a b ”Hapot”, Iso tietosanakirja, 4. osa (Gottlund–Ihmels), s. 397. Otava, 1932.
- ↑ Brønsted base IUPAC GolBook. Viitattu 1.7.2013. (englanniksi)
- ↑ a b ”Eräitä happoihin ja emäksiin liittyviä käsitteitä”, Kemia 1, s. 101–102. WSOY, 1968.
- ↑ Lewis base IUPAC GolBook. Viitattu 1.7.2013. (englanniksi)
- ↑ Electrophiles and Nucleophiles chem.ucla.edu. Arkistoitu 18.2.2019.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Happo-emäsreaktio Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Happo-emäsreaktio Wikimedia Commonsissa
