Vetyjodidi
| Vetyjodidi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | HI |
| Moolimassa | 127,908 g/mol |
| Ulkomuoto | Väritön tai kellertävä kaasu.[1] |
| Sulamispiste | –50,77 °C [2] |
| Kiehumispiste | –35,55 °C [2] |
| Tiheys | 5,23 g/dm3 |
| Liukoisuus veteen | 57 g/100ml (20 °C) [3] |
Vetyjodidi (HI) on jodin ja vedyn muodostama epäorgaaninen molekyyliyhdiste. Yhdisteen vesiliuos on voimakkaasti hapan ja liuosta kutsutaan usein jodivetyhapoksi. Vetyjodidia käytetään kemikaalien valmistuksessa ja pelkistimenä.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Fysikaaliset ominaisuudet
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa vetyjodidi on kellertävä tai väritön kaasu ja sillä on pistävä haju. Väkevät liuokset muodostavat kosteassa ilmassa höyryjä. Yhdiste liukenee hyvin veteen ja 10 °C:n lämpötilassa litra vettä liuottaa noin 15 moolia vetyjodidikaasua. Veden kanssa aine muodostaa erilaisia hydraatteja, joiden koostumus vaihtelee. Vetyjodidi muodostaa atseotrooppisen seoksen veden kanssa. Seoksen vetyjodidipitoisuus on 57 % ja se kiehuu 126,7 °C:n lämpötilassa.[1][4]
Kemialliset ominaisuudet
[muokkaa | muokkaa wikitekstiä]Vetyjodidin vesiliuos on erittäin vahva happo ja yhdiste protolysoituu lähes täydellisesti muodostaen jodidi- ja oksoniumioneita HI + H2O → I- + H3O+. Happo on syövyttävää ja sitä käsiteltäessä tulee käyttää suojavaatetusta, -käsineitä, kasvojensuojainta ja hengityssuojainta.[5]
Vetyjodidin laimeat vesiliuokset ovat varsin pysyviä, mutta hapen läsnä ollessa yhdiste hajoaa vedeksi ja vapaaksi jodiksi, minkä vuoksi liuos muuttuu ruskeaksi.[1]
- 4 HI + O2 → 2 I2 + 2 H2O
Vetyjodidi on vahvempi pelkistin kuin muut vedyn halogeeniyhdisteet ja tämän vuoksi voimakkaat hapettimet, kuten kloori, bromi tai typpihappo hapettavat vetyjodidin alkuainejodiksi.[4]
- 2 HI + Br2 → I2 + 2 HBr
Valmistus
[muokkaa | muokkaa wikitekstiä]Vetyjodidia voidaan valmistaa usealla tavalla teollisesti. Tavallisemmin yhdistettä tuotetaan jodin ja hydratsiinin välisellä reaktiolla.[2]
- 2 I2 + N2H4 → 4 HI + N2
Mikäli vetyjodidin on oltava erityisen puhdasta valmistetaan sitä jodista ja vetykaasusta. Höyrystetty jodi ja vety johdetaan 500 °C:n lämpötilassa rakenteeltaan sienimäisen platinakatalyytin läpi, jolloin lähtöaineet reagoivat ja syntyy vetyjodidia.[4]
- I2 + H2 → 2 HI
Vetyjodidia on mahdollista valmistaa myös jodin ja vetysulfidikaasun välisellä reaktiolla, johtamalla fosforitrijodidia veteen tai fosforista, jodista ja vedestä.[1][4]
- H2S + I2 → 2 HI + S
- PI3 + 3 H2O → 3 HI + H3PO3
- 2 P + 3 I2 + 6 H2O → 6 HI + 2 H3PO3
Käyttö
[muokkaa | muokkaa wikitekstiä]Vetyjodidia käytetään kemianteollisuudessa pelkistimenä ja valmistettaessa jodidisuoloja.[1]
Käyttö orgaanisessa synteesissä
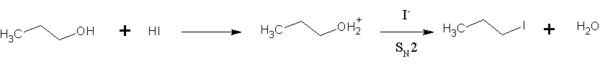
[muokkaa | muokkaa wikitekstiä]Vetyjodidi reagoi eetterien kanssa muodostaen jodialkaaneja ja alkoholeja. Myös alkoholit kykenevät reagoimaan vetyjodidin kanssa, jolloin tuotteina muodostuu niin ikään jodialkaaneja. Vetyjodidi on happamin vedyn halogeeniyhdisteistä ja jodidi-ioni on tällöin niistä paras nukleofiili. Siksi vetyjodidi reagoi helpommin kuin esimerkiksi vetybromidi.[6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e E.M.Karamäki: Epäorgaaniset kemikaalit, s. 127. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3
- ↑ a b c Dale L. Perry,Sidney L. Phillips: Handbook of inorganic compounds, s. 194. CRC Press, 1995. ISBN 9780849386718 Kirja Googlen teoshaussa Viitattu 30.3.2010. (englanniksi)
- ↑ Vetyjodidin kansainvälinen kemikaalikortti Viitattu 30.3.2010
- ↑ a b c d Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 432–433. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa Viitattu 30.3.2010. (englanniksi)
- ↑ Vetyjodidi Työterveyslaitos. Viitattu 5.8.2024.
- ↑ Peter R. S. Murray: Principles of organic chemistry, s. 199. Heinemann, 1977. ISBN 978-0435656430 Kirja Googlen teoshaussa Viitattu 30.3.2010. (englanniksi)