Mitsunobu-reaktio

Mitsunobu-reaktio on kemiallinen reaktio jossa alkoholien hydroksyyliryhmä korvautuu jollain nukleofiilisella ryhmällä. Reaktiossa käytetään aktivoivia reagensseja, joita ovat trifenyylifosfiini ja dietyyliatsodikarboksylaatti tai heksaklooriasetoni. Reaktio on saanut nimensä japanilaisen kemistin Oyo Mitsunobun mukaan.[1]
Reagenssit ja mekanismi
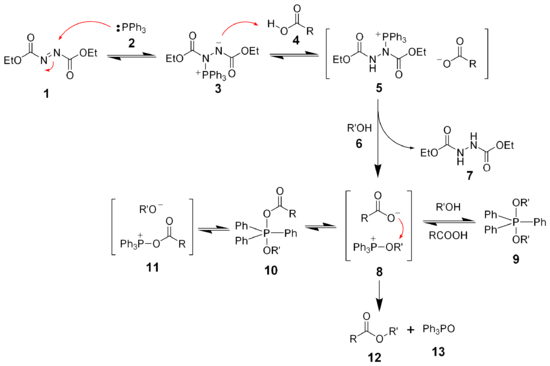
[muokkaa | muokkaa wikitekstiä]Mitsunobu-reaktion substraattina toimivat useat alkoholit. Erityisen hyvin se soveltuu allyylisille alkoholeille, joista esimerkiksi allyylikloridien valmistaminen selektiivisesti on muuten vaikeaa. Aktivoivina reagensseina käytetään trifenyylifosfiinia ja dietyyliatsodikarboksylaattia tai heksaklooriasetonia. Dietyyliatsodikarboksylaatti voi olla räjähdysherkkää ja reaktiossa muodostuu stoikiometrinen määrä jätteeksi päätyvää trifenyylifosfiinioksidia. Tämän vuoksi on kehitetty polymeereihin sidottuja atsokarboksylaatti- ja fosfonikatalyyttejä. Mitsunobu-reaktioon soveltuvien nukleofiilien kirjo on laaja. Käytettäessä Karboksyylihappoja muodostuu estereitä, alokoholeista muodostuu eettereitä, vetyhalogenideja käyttällä muodostuu halogenoituja johdannaisia, amiineista muodostuu alkyloituja amiineja, amideista muodostuu alkyloituja amideja, atsideista muodostuu orgaanisia atsideja ja fosfiiteista fosfiittiestereitä. [1][2][3][4]
Mitsunobu-reaktion ensimmäisessä vaiheessa trifenyylifosfiini reagoi dietyyliatsodikarboksylaatin tai heksaklooriasetonin kanssa. Mekanismit poikkeavat hieman toisistaan, mutta molempiin sisältyy nukleofiilinen substituutio fosforiatomiin. Käytettäessä dietyylisiatsokarboksylaattia trifenyylifosfiini muodostaa additiotuotteen atsokarboksylaatin atsoryhmän kanssa. Tässä muodostuu välituotteena typpianioni, joka on riittävän emäksinen poistamaan protonin alkoholilta ja alkoholista muodostuu alkoksidi. Seuraavassa vaiheessa nukleofiilinen alkoksidi-ioni reagoi nukleofiilisella substituutiolla Fosfiiniryhmän fosforiatomin kanssa ja lähtevänä ryhmänä on anioni, jossa on typellä negatiivinen varaus. Toinen tuote on fosfoniumioni. Typpianioni reagoi nukleofiilinen kanssa poistaen tältä protonin ja siten edelleen parantaen nukleofiilisuutta. Tämä näin muodostunut nukleofiili reagoi nukelofiilisella SN2 reaktiolla fosfoniumsuolan hiiliatomin kanssa ja lähtevä ryhmä on trifenyylifosfiinioksidi.[1]
Koska Mitsunobu-reaktio on SN2-reaktio mekanismiltaan, tapahtuu kiraalisten alkoholien ollessa substraatteina stereokemian inversio. Tämä tarkoittaa sitä, että R-enantiomeeri tuottaa S-enantiomeerin tuotteeksi ja S-alkoholi muodostaa R-konfiguraation omaavan tuotteen.[1][4]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 349–351. Oxford University Press, 2012. ISBN 978-0-19-927029-3 (englanniksi)
- ↑ Michael B. Smith & Jerry March: March's Advanced Organic Chemistry. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1 (englanniksi)
- ↑ Francis A. Carey & Richard J. Sundberg: Organic Chemistry B: Reactions and synthesis, s. 535, 540, 559, 570. Springer, 2007. ISBN 978-0-387-68350-8 (englanniksi)
- ↑ a b Takanori Iwasaki, Yusuke Maegawa, Takashi Ohshima & Kazushi Mashima: Esterification, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2012. Viitattu 22.8.2014