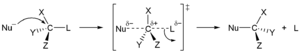Nukleofiilinen substituutio
Nukleofiilinen substituutio on substituutioreaktiotyyppi, jossa nukleofiili korvaa orgaanisen yhdisteen rakenteessa lähtevän ryhmän. Reaktiossa nukleofiili luovuttaa elektrofiiliselle hiiliatomille elektroniparin ja lähtevä ryhmä irtoaa alkuperäisen sidoksen elektronipari mukanaan. Nukleofiilinen substituutio voi tapahtua usealla eri mekanismilla, joista tärkeimmät ovat SN1- ja SN2-mekanismit. Tiedot reaktioista pohjautuvat huomattavasti Christopher Kelk Ingoldin ja E. D. Hughesin 1930-luvulla tekemiin tutkimuksiin.[1][2][3]
Esimerkki nukleofiilisesta substituutiosta on alkyylibromidin reaktio hydroksidi-ionin kanssa, missä hydroksidi-ioni on nukleofiili ja bromidi-ioni lähtevä ryhmä.
- R-Br + OH- → R-OH + Br-
Mekanismit
[muokkaa | muokkaa wikitekstiä]SN1-reaktio
[muokkaa | muokkaa wikitekstiä]Ensimmäisen kertaluvun nukleofiinen substituutio eli SN1-reaktio on toinen yleisimmistä nukleofiilisen substituution reaktiomekanismeista. SN1-reaktiossa reaktio on ensimmäistä kertalukua elektrofiilin RX suhteen ja reaktion nopeus ei riipu reaktioon osallistuvasta nukleofiilista. Reaktion nopeusyhtälö on muotoa[1][2][3]
- r=k[RX]

SN1-reaktion mekanismi on kaksivaiheinen. Ensimmäisessä vaiheessa reaktion lähtevä ryhmä lähtee sidoselektronit mukanaan, jolloin muodostuu positiivisesti varautunut karbokationi. Tämä vaihe on hidas ja niin kutsuttu reaktionopeuden määräävä vaihe. Tyypillisiä lähteviä ryhmiä ovat halogeeneista kloori, bromi ja jodi ja happamissa olosuhteissa alkoholien hydroksyyliryhmä. Toisessa vaiheessa nukleofiili reagoi karbokationin kanssa muodostaen tuotteen, ja tämä on huomattavasti karbokationin muodostumista nopeampi vaihe. SN1-reaktio tapahtuu parhaiten silloin, kun muodostuva karbokationi on tertiäärinen. Sekundäärisen karbokationin muodostaville lähtöaineille se on hitaampi, ja primäärisen tai metyylikationin muodostavat yhdisteet eivät reagoi lainkaan tämän reaktiomekanismin mukaisesti. Tämä johtuu siitä, että tertiäärinen karbokationi on näistä stabiilein ja primääriset tai metyylikationit ovat hyvin epästabiileja[1][2][3][4]
Jos lähtöaine on SN1-reaktiossa optisesti aktiivinen, reaktiossa tapahtuu rasemoituminen eli tuotteena saadaan raseeminen seos. Tämä johtuu siitä, että SN1-reaktion karbokationivälituote on tasomainen, jolloin nukleofiili voi liittyä karbokationiin kummaltakin puolelta ja reaktiossa syntyy kumpaakin stereoisomeeria yhtä paljon. Esimerkiksi

kun (R)-2-bromibutaania hydrolysoidaan, saadaan (R)- ja (S)-2-butanolin raseeminen seos. Sivureaktiona voi tapahtua eliminaatioreaktiota, kun käytetään vahvasti emäksisiä nukleofiileja, kuten alkoksideja tai hydroksideja. Liuottimina SN1-reaktioissa käytetään usein proottisia polaarisia liuottimia, kuten alkoholeja tai vettä.[1][2][3][4]

SN2-reaktio
[muokkaa | muokkaa wikitekstiä]Toisen kertaluvun nukleofiilinen substituutio eli SN2-reaktio on toinen yleinen nukleofiilisen substituution reaktiomekanismi. Se on toista kertalukua, ja reaktionopeus riippuu sekä elektrofiilin että nukleofiilin konsentraatiosta.[1][2][3] SN2-reaktiolle reaktionopeusyhtälö on muotoa:
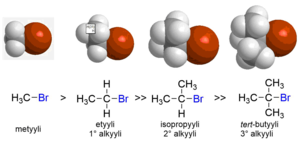
Mekanismiltaan SN2-reaktio on niin kutsuttu yhtäaikaisreaktio. Nukleofiili hyökkää elektrofiiliin samanaikaisesti kuin lähtevä ryhmä irtoaa. Reaktion siirtymätilassa lähtevän ryhmän ja lähtöaineen välinen sidos on osittain hajonnut ja lähtöaineen ja nukleofiilin välinen sidos on osittain muodostunut. SN2-reaktioissa metyyli- ja primääriset halogenidit reagoivat parhaiten, sekundääriset alkyylihalogenidit heikommin ja tertiääriset eivät juuri lainkaan. SN2-reaktioon vaikuttaa sekä nukleofiilin että elektrofiilin steerinen ympäristö. Jos nukleofiilillä on esteetön pääsy elektrofiiliseen hiiliatomiin, esimerkiksi metyylibromidin tapauksessa, reaktio tapahtuu SN2-mekanismilla. Reaktio hidastuu, jos metyylin tilalla on suurempi ryhmä, kuten etyyli-, isopropyyli- tai tert-butyyli. Kun alkyyliryhmä on suurempi, elektrofiilinen hiiliatomi ei ole enää ole helposti nukleofiilin saavutettavissa, joten eri alkyylibromidien suhteellinen reaktiivisuusjärjestys on: CH3Br > CH3CH2Br >> (CH3)2CH-Br >> (CH3)3CBr
Hyviä nukleofiileja näissä reaktioissa ovat amiinit, alkoksidit, hydroksidit ja sulfidit, jotka ovat kaikki voimakkaita nukleofiileja.[1][2][3][4]

Jos lähtöaine on optisesti aktiivinen, reaktiossa tapahtuu stereokemian inversio eli R-isomeeri muuttuu S-isomeeriksi ja päinvastoin. Siirtymätilan rakenne selittää, miksi SN2-reaktiossa tapahtuu konfiguraation inversio. Jos esimerkiksi (S)-2-bromibutaani reagoi hydroksidi-ionin kanssa, nukleofiili (OH-) hyökkää kohti hiili-elektrofiilia C-Br-sidoksen akselia pitkin, jonka vuoksi lähtevä ryhmä irtoaa vastakkaiselta puolelta. Liuottimena SN2-reaktioissa käytetään usein aproottisia polaarisia liuottimia kuten dimetyyliformamidia.[1][2][3]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, s. 407–444. Oxford University Press, 2008. ISBN 978-0-19-850346-0 (englanniksi)
- ↑ a b c d e f g Francis A. Carey & Richard J. Sundberg: Advanced Organic Chemistry A: Structure and Mechanisms, s. 389–404. Springer, 2007. ISBN 978-0-387-44897-8 (englanniksi)
- ↑ a b c d e f g Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, s. 425–440. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1 (englanniksi)
- ↑ a b c Halogeenialkaanien reaktiot Etälukio. Opetushallitus. Arkistoitu 4.3.2016. Viitattu 16.4.2013.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Nukleofiilinen substituutio Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Nukleofiilinen substituutio Wikimedia Commonsissa