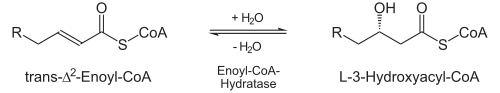β-oksidaatio
β-oksidaatio eli beetaoksidaatio on rasvahappojen aineenvaihdunnan reitti, jossa kehon solut tuottavat ruoan tai rasvasolujen rasvahappoja hapettamalla yleensä energiaa ATP:n muotoon. Reitin nimi tulee siitä, että siinä hapetetaan eli oksidoidaan rasvahappojen β-hiiliä karbonyyleiksi.

β-oksidaatio tapahtuu ihmisten ja monien eläinten solujen mitokondrioissa ja peroksisomeissa.[1] Se ei silti esimerkiksi nisäkkäillä tapahdu punasoluissa, koska näistä mitokondriot poistuvat solukehityksen aikana toisin kuin kaloilta ja ehkä joiltain muiltakin selkärankaisilta.[2] Oksidaatiota ei juurikaan tapahdu myöskään nisäkkäiden hermosoluissa, koska näissä ei tuoteta juurikaan β-oksidaation entsyymeitä.[3] Syytä kumpaankaan solutyypin entsyymipuutokseen ei tiedetä varmuudella.[2][3]
Kasveilla β-oksidaatio tapahtuu glyoksisomeissa ja peroksisomeissa. Myös kasvien mitokondrioissa voi ehkä tapahtua jossain määrin β-oksidaatiota. Reitillä kasvit tosin tekevät rasvahapoista lähinnä biosynteesin raaka-aineita, eikä energiaa.[4]
Useimmilla sienillä kuten leivinhiivalla β-oksidaatio tapahtuu vain peroksisomeissa.[4]
Rasvahapot ovat usein triglyserideinä kiinni glyserolissa, jota ei käsitellä β-oksidaatiossa. Se hydrolysoituu irti rasvahapoista ja energiaksi mennessään glyseroli menee glyserolikinaasin kautta glyseroli-3-fosfaattina glykolyysiin.[1]
β-oksidaatiolle vaihtoehtoinen reitti on ω-oksidaatio, mutta tämä on nisäkkäillä paljon vähäisempi ja valtaosa rasvahapoista käy läpi β-oksidaation. ω-oksidaatiossa rasvahappoja hapetetaan niiden ketjun pään ω-hiilestä, joka on kauimmainen hiili rasvahapon karboksyyliryhmästä. Reitti tapahtuu selkärankaisilla maksa- ja munuaissolujen solulimakalvostoissa ja lähinnä 10–12 hiilen rasvahapoille.[1]
Rasvahappojen sisäänotto
[muokkaa | muokkaa wikitekstiä]Solukalvon läpäisy
[muokkaa | muokkaa wikitekstiä]Veressä rasvahapot kuljetaan kylomikroneissa triglyserideinä ja paljon vähemmässä määrin albumiiniin sitoutuneina rasvahappoina.[5]
Ihmisillä kylomikronin apoC-II -lipoproteiini aktivoi verisuonten sisäpintaan (endoteeliin) sitoutuneen lipoproteiinilipaasin, joka hydrolysoi triglyserigit vapaiksi rasvahapoiksi ja glyseroleiksi. Lihassoluissa sisäänotetut rasvahapot päätyvät β-oksidaatioon mitokondrioon päästyään, mutta rasvasoluissa ne lähinnä käsitellään, esteröidään uudelleen ja säilötään rasvakudokseen. Lähes tyhjentyneen kylomikronin jäämät kulkevat veressä maksaan, jossa ne käsitellään vereen vapautuviksi VLDL:iksi. Nämä kuljettavat loput rasvahapoista rasvasoluihin.[1]
Ihmisillä glukagonin ja epinefriinin sitoutuminen rasvasolujen pinnalle saa cAMP kautta PKA:n fosforyloimaan perilipiini A:n. Tämä kuljettaa rasvasolun pinnalle hormoniherkän lipaasin, joka hydrolysoi rasvasolun triglyseridejä vapauttaen vereen vapaita rasvahappoja.[1] Rasvahapot eivät liukene vereen sellaisenaan. Siksi ne ensin sitoutuvat vesiliukoiseen albumiiniin, joka sitoo jopa 7 rasvahappoa kerralla. Tähän sitoutuneena ne kelkevat veren mukana lähinnä lihassoluille.[5]
Mitokondrion läpäisy
[muokkaa | muokkaa wikitekstiä]Likimain alle 12 hiilen rasvahapot voivat päästä solulimasta mitokondrion sisäkalvon läpi itsestään diffuusiolla ilman kuljetusproteiineja. Valtaosa ruoan rasvahapoista on kuitenkin yli 14 hiiltä pitkiä ja nämä kuljetetaan mitokondrion sisäkalvon sisäiseen nesteeseen, matriksiin.[1]
Kuljetus tapahtuu karnitiini-sukkula -järjestelmän avulla. Eripituisille rasvahapoille on useita pitkäketjuisten rasvahappojen CoA-ligaasien (EC 6.2.1.3) isotsyymejä. Solulimassa nämä katalysoivat tioesterin muodostumista rasvahapon karboksyylin (-COOH) ja koentsyymi A:n (lyhenne CoA) tiolin (-SH) välille ATP:n tuoman energian avulla:[1]
Rasva-asyyli-CoA päätyy satunnaisen liikkeen kautta mitokondrion ulkokalvon karnitiiniasyylitransferaasi I:lle (geeni CPT1A). Tapahtuu vaihtoesteröinti ja CoA vapautuu vaihtuen L-karnitiiniin. Rasvahappo sitoutuu karboksyylistään karnitiinin hydroksyyliin. Reaktio on:[1]
- rasva-asyyli-CoA + L-karnitiini ⇌ rasva-asyylikarnitiini + CoA
Rasva-asyylikarnitiini kulkeutuu mitokondrion sisäkalvon karnitiini-asyylikarnitiinitranslokaasin (geeni SLC25A20) kautta matriksiin. Matriksissa rasva-asyylikarnitiini vaihtoesteröityy karnitiiniasyylitransferaasi II:lla (geeni CPT2) CoA kanssa:[1]
- rasva-asyylikarnitiini + CoA ⇌ rasva-asyyli-CoA + L-karnitiini
Rasva voi nyt siirtyä β-oksidaatioon. Karnitiini palaa translokaasin kautta mitokondrion ulkokalvolle reagoimaan seuraavien rava-asyyli-CoA -molekyylien kanssa.[1]

Tyydyttyneet rasvat ja yksöissidokset
[muokkaa | muokkaa wikitekstiä]Mitokondrio-oksidaatio
[muokkaa | muokkaa wikitekstiä]β-oksidaatio tapahtuu tyydyttyneillä rasvahapoilla neljässä vaiheessa: dehydraus, hydrataatio, hapetus ja tiolyysi.[1]
Dehydrauksessa FAD poistaa 2 vetyä rasvahaposta asyyli-CoA-dehydrogenaasilla (usea isotsyymi). C2-3 väliin tulee trans-sidos:[1]
Hydrataatiossa vesi liitetään C2-3 kaksoissidokseen enoyyli-CoA-hydrataasilla (EC 4.2.1.17). Sidos pelkistyy, C3:en liittyy OH-ryhmä ja muodostuu S- eli L-isomeeri:[1]
Hapetuksessa NAD+ poistaa 2 vetyä 3-hydroksiasyyli-CoA-dehydrogenaasilla (EC 1.1.1.35). C3:n OH hapettuu karbonyyliksi:[1]
Tiolyysissä β-ketotiolaasin (EC 2.3.1.16) liittämä CoA:n tioli (-SH) katkaisee C2-3 sidoksen muodostaen tilalle tioesterin:[1]
Reaktiosarja alkaa alusta. Joka toistossa rasvahaposta poistuu 2 hiiltä asetyyli-CoA:na kunnes rasvahappo on kulunut loppuun. Tiolyysin asetyyli-CoA siirtyy yleensä sitruunahappokiertoon mennen siten ATP:n tuottoon. Muissa vaiheissa saadut NADH ja FADH2 päätyvät ATP:n tuottoon menemällä mitokondrion elektroninsiirtoketjuun.[1]
Asyyli-CoA-dehydrogenaasista (AD) on ihmisillä (ja useilla muilla nisäkkäillä) 4 entsyymityyppiä (isotsyymiä), jotka dehydraavat rasvahappoja näiden pituuden mukaan:
- VLCAD, Very-Long-Chain AD (EC 1.3.8.9) - ei toimi alle 12 C rasvahapoille, toimii parhaiten 14–18 C rasvahapoille ja toimii jopa 24 C rasvahapoille.[6]
- LCAD, Long-CAD (EC 1.3.8.8) - ei toimi alle 6 C tai yli 24 C rasvahapoille ja toimii parhaiten 14–16 C rasvahapoille.[7]
- MCAD, Medium-CAD (EC 1.3.8.7) - sian entsyymi ei toimi alle 4 C tai yli 16 C rasvahapoille ja toimii parhaiten 8–12 C rasvahapoille.[8]
- SCAD, Short-CAD (EC 1.3.8.2) - naudan entsyymi toimii 3–8 C rasvahapoille.[9]
Kun rasvahappo on alle 12 hiiltä pitkä, hapetetaan se mitokondrion matriksissa ja erillisin edellä reaktiovaiheissa mainituin entsyymein. Jos se on yli 12 hiiltä pitkä, hoitaa hydrataation, hapetuksen ja tiolyysin mitokondrion sisäkalvolla mitokondrion kolmitoiminen proteiini, MTP (eng. mitochondrial trifunctional protein).[1] Kompleksi koostuu kaksitoimisesta α-yksiköstä (HADHA, hoitaa hydrataation ja hapetuksen)[10] ja yksitoimisesta β-yksiköstä (HADHB, hoitaa tiolyysin).[11]
Peroksisomioksidaatio
[muokkaa | muokkaa wikitekstiä]Mitä pidempiä rasvahappojen hiiliketjut ovat, sitä suuremmassa määrin niiden hapetus tapahtuu peroksisomeissa.[12] Näissä hapetaan pääasiassa lähinnä yli 20 hiilen rasvahappoja,[13] ja ketjujen lyhentyessä tarpeeksi hapetus siirtyy normaalisti lopulta kokonaan takaisin mitokondrioon, jossa se etenee loppuun asti.[12]
Rasvahapot hapetetaan peroksisomeissa samoin reaktioin kuin mitokondrioissa, mutta osin eri entsyymein. Peroksisomit käsittelevät jopa 26 hiilen rasvahappoja (kuten keroottihappo) ja haarautuneita rasvahappoja, kuten fytaanihappoja ja pristaanihappoja.[1] Fytaanihapon täytyy tosin ensin muuntua peroksisomin α-oksidaatiossa pristaanihapoksi, joka voi käydä läpi β-oksidaation.[14]

Peroksisomissa ei dehydrausvaiheessa muodostu ATP:tä sillä FADH2 vedyt siirretään hapelle O2 ja saadaan vetyperoksidia (H2O2). Tämä on soluja vaurioittava hapetin ja siitä tulee päästä eroon, joten katalaasi muuntaa sen pian vedeksi.[1] Reaktiossa muodostuu lämpöä.[15] Hapetuksessa muodostuu kuitenkin NADH:ta, joka kuljetetaan mitokondrioon ATP tuottoon.[1]
cis-sidokset
[muokkaa | muokkaa wikitekstiä]2-cis
[muokkaa | muokkaa wikitekstiä]Esimerkiksi petroseliinihappo (18:1 cis-6) sisältää 2-cis -sidoksen β-oksidaation edettyä kyllin pitkälle.
Jos tyydyttymätön rasvahappo sisältää 2-cis -sidoksen, enoyyli-CoA-hydrataasi hydratoi sidoksen ihmisillä kuten tyydyttyneiden rasvojen -osiossa. Tyydyttyneiden käsittelystä poiketen tuotteeksi muodostuu kuitenkin D-3-hydroksiasyyli-CoA (R-isomeeri). Eli:[16]
Ihmisten ja muiden nisäkkäiden 3-hydroksiasyyli-CoA-dehydrogenaasi ei voi hapettaa tätä isomeeriä,[16] mutta on eliöitä, joiden kyseinen entsyymi pystyy tähän.[17] Tiettävästi nisäkkäät, kasvit ja jotkin bakteerit käsittelevät D-3-hydroksiasyyli-CoA:n peroksisomeissa (käsittelyä ei tapahdu mitokondrioissa) kahdella vaihtoehtoisella reitillä.[4]
1. vaihtoehtoisessa reitissä 3-hydroksiasyyli-CoA-epimeraasi (EC 5.1.2.3) muuntaa D-3-hydroksiasyyli-CoA:n S- eli L-isomeeriksi, joka voidaan viedä β-oksidaation hapetusvaiheeseen. Reaktio on:[4]
- R-hydroksiasyyli-CoA ⇌ L-3-hydroksiasyyli-CoA
2. vaihtoehtoisessa reitissä enoyyli-CoA-hydrataasi 2 (EC 4.2.1.119) muuntaa D-3-hydroksiasyyli-CoA:n (2E)-enoyyli-CoA:ksi, joka menee β-oksidaation hydrataatiovaiheeseen. Reaktio on:[4]
3-cis
[muokkaa | muokkaa wikitekstiä]Esimerkiksi linolihappo (18:2 9,12-cis) sisältää 3-cis -sidoksen β-oksidaation edettyä kyllin pitkälle.
3-cis -sidosta ihmiset eivät voi hydratoida saatavilla olevin entsyymein, joten sen muuntaa 2-trans -sidokseksi 3,2-trans-enoyyli-CoA-isomeraasi (EC 5.3.3.8):[1]
Sitten enoyyli-CoA-hydrataasi hydratoi trans-sidoksen kuten tyydyttyneiden rasvahappojen kohdalla ja β-oksidaatio tapahtuu ainakin kerran.[1]
Luonnon monityydyttymättömissä rasvahapoissa cis-kaksoissidokset ovat tosin lähes poikkeuksetta kahden yksöissidoksen päässä toisistaan kuten vaikka linolihapossa. Siksi ensimmäisen kaksoissidoksen käsittelyn jälkeisen yhden β-oksidaatiokierroksen ja asyyli-CoA-dehydrogenaasin dehydrauksen jälkeen rasvahapossa on konjugoidut 2-trans- ja 3-cis -sidokset. 2,4-dienoyyli-CoA-reduktaasi (EC 1.3.1.34) pelkistää nämä sidokset NADPH avulla yhdeksi 3-trans -sidokseksi:[1]
3,2-trans-enoyyli-CoA-isomeraasi muuntaa tuotteen kaksoissidoksen taas 2-trans -sidokseksi josta tuote menee β-oksidaation hydrataatiovaiheeseen.[1]
Alla on kuvattu linolihapon loppuun asti etenevä β-oksidaatio, johon kaikki edellä kuvatut entsyymit osallistuvat.

trans-sidokset
[muokkaa | muokkaa wikitekstiä]2-trans
[muokkaa | muokkaa wikitekstiä]Esimerkiksi linoelaidiinihappo (18:2 9,12-trans) sisältää 2-trans -sidoksen β-oksidaation edettyä ensimmäisestä kaksoissidoksesta seuraavaan.
Jos transrasvassa on 2-trans -sidos, enoyyli-CoA-hydrataasi hydratoi sidoksen ihmisillä ja reaktiot tästä eteenpäin jatkuvat normaalisti (katso Mitokondrio-oksidaatio). Muodostuu S- eli L-isomeeri:[18]
3-trans
[muokkaa | muokkaa wikitekstiä]Esimerkiksi elaidiinihappo (18:1 9-trans) sisältää 3-cis -sidoksen β-oksidaation edettyä kyllin pitkälle.
Jos trans-sidos on C3-4 välissä, 3,2-trans-enoyyli-CoA-isomeraasi siirtää ihmisillä sidoksen yhdellä hiilellä eteenpäin ja enoyyli-CoA-hydrataasi jatkaa tästä kuten yllä (2-trans osio). Isomeraasin reaktio on:[18]
Hiililtään parittomat rasvahapot
[muokkaa | muokkaa wikitekstiä]Valtaosassa ruoan ja luonnon rasvahapoista ei ole paritonta lukumäärää hiiliä,[1] kuten vaikka margariinihapossa (17:0) on, mutta keho pystyy hajottamaan näitäkin.
Rasvahapon yksöis- ja kaksoissidokset hajotetaan tapauskohtaisesti tässä artikkelissa kuvatuin tavoin kunnes jäljellä on 3 hiilinen propionihappo tioesteröitynä propionyyli-CoA:ksi. Ihmisillä propionyyli-CoA-karboksylaasi liittää hiilidioksidin propionyylin C2:teen eli karboksyloi sen. Muodostuu S-metyylimalonyyli-CoA. Metyylimalonyyli-CoA-rasemaasi muuttaa tämän R-metyylimalonyyli-CoA:ksi. Metyylimalonyyli-CoA-mutaasi muuttaa tämän sukkinyyli-CoA:ksi, joka menee sitruunahappokiertoon. Reaktio on:[1]
Konjugoidut rasvahapot
[muokkaa | muokkaa wikitekstiä]Konjugoiduissa rasvahapoissa kuten rumeenihapossa (18:2 9-cis,11-trans) on vähintään kaksi kaksoissidosta, joita erottaa yksi yksöissidos kahden sijaan, kuten tyydyttymättömissä rasvahapoissa yleensä. Kaksoissidokset ovat siksi konjugoituneet ja niistä ei-kumpikaan, toinen tai molemmat voivat olla trans-sidoksia loppujen ollessa cis-sidoksia.
Δ3,5Δ2,4-dienoyyli-CoA-isomeraasi (EC 5.3.3.21) käsittelee ihmisillä 3,5-dienoyyli-CoA:n, jossa on 3-trans- ja 5-cis -sidokset. Muodostuu (2E,4E)-dienoyyli-CoA, jossa on C2-3 ja C4-5 välillä konjugoituneet trans-sidokset. Reaktio on:[16]
2,4-dienoyyli-CoA-reduktaasi käsittelee tuotteen kuten alla ja tätä seuraava reaktio on 3,2-trans-enoyyli-CoA-isomeraasilla (katso 3-cis).[16]
Energiasaanto
[muokkaa | muokkaa wikitekstiä]Keho varastoi rasvahappojen kemiallisen energian ATP:ksi, jota käytetään sitten kehossa tuomaan energiaa esimerkiksi entsyymien reaktioihin.
Oksidatiivinen fosforylaatio ei tapahdu täydellisesti, joten ATP:tä muodostuu karkeasti noin 1.5 per FADH2, 2.5 per NADH ja 10 per asetyyli-CoA. Yksittäisessä tyydyttymättömän sidoksen β-oksidaatiokierroksessa muodostuu näitä kaikkia aineita yksi, joten kierroksessa muodostuu kokonaisuudessaan 14 ATP:tä (1.5 + 2.5 + 10).[1] Teoreettinen ATP-saanto olisi 2 per FADH2, 3 per NADH[19] ja 12 per asetyyli-CoA (= 3 NADH + 1 FADH2 + 1 GTP).[1][19]
Tyydyttyneelle rasvahapolle, jossa on parillinen määrä hiiliä, β-oksidaatio voi tapahtua n/2-1 -kertaa. n on hiilten lukumäärä. Kussakin asetyyli-CoA:ssa on kaksi hiiltä, joten kaava jaetaan kahdella, ja viimeissä β-oksidaatiokierroksessa muodostuu kaksi asetyyli-CoA -molekyyliä, joten kaavasta vähennetään yksi ja kaavan loppuun lisätään 10. Rasvahappo tulee kuitenkin β-oksidaation alussa liittää CoA-molekyyliin. Tämä vaatii 2 ATP:tä, jotka vähennetään lopullisesta kaavasta.
Siten tyydyttyneiden ja parillisen hiililuvun omaaville rasvahapoille ATP-saantokaava on:
- (n/2-1) * 14 + 10 - 2 = ATP-saanto
Siten palmitiinihappo (16:0) tuottaa 106 ATP:tä, eli:
- (16/2 - 1) * 14 + 10 - 2 = 106 ATP
Kaava vastaa likimääräisesti todellisuutta jos β-oksidaation oletetaan tapahtuvan mitokondriossa, eikä osittain peroksisomissa (jossa erityisen pitkät rasvahapot käsitellään).
Katso myös
[muokkaa | muokkaa wikitekstiä]- Lipolyysi
- Glykolyysi, hiilihydraattien hajotusreitti
- Ureasykli, aminohappojen hajotusreitti
- Sitruunahappokierto, hiilihydraattien ja aminohappojen hajotusreitti
- Oksidatiivinen fosforylaatio, ATP:n tuottoreitti
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab DL Nelson & MM Cox: Lehninger principles of biochemistry, s. 621, 648–665. (5. painos) New York: W.H. Freeman, 2008. OCLC: 191854286. LCCN: 2007941224 ISBN 9780716771081 Teoksen verkkoversio.
- ↑ a b A Stier et al.: Avian erythrocytes have functional mitochondria, opening novel perspectives for birds as animal models in the study of ageing. Frontiers in Zoology, 8.6.2013, 10. vsk, nro 1, s. 33. PubMed:23758841 doi:10.1186/1742-9994-10-33 ISSN 1742-9994 Artikkelin verkkoversio.
- ↑ a b P Schönfeld, G Reiser: Why does brain metabolism not favor burning of fatty acids to provide energy? - Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow & Metabolism, lokakuu 2013, nro 10, s. 1493–1499. PubMed:23921897 doi:10.1038/jcbfm.2013.128 ISSN 0271-678X Artikkelin verkkoversio.
- ↑ a b c d e L Allenbach, Y Poirier: Analysis of the Alternative Pathways for the β-Oxidation of Unsaturated Fatty Acids Using Transgenic Plants Synthesizing Polyhydroxyalkanoates in Peroxisomes. Plant Physiology, marraskuu 2000, 124. vsk, nro 3, s. 1159–1168. PubMed:11080293 doi:10.1104/pp.124.3.1159 ISSN 0032-0889 Artikkelin verkkoversio.
- ↑ a b GJ van der Vusse: Albumin as fatty acid transporter. Drug Metabolism and Pharmacokinetics, 2009, 24. vsk, nro 4, s. 300–307. PubMed:19745557 doi:10.2133/dmpk.24.300 ISSN 1880-0920 Artikkelin verkkoversio.
- ↑ ENZYME entry 1.3.8.9 enzyme.expasy.org. Viitattu 15.8.2018.
- ↑ ENZYME entry 1.3.8.8 enzyme.expasy.org. Viitattu 15.8.2018.
- ↑ ENZYME entry 1.3.8.7 enzyme.expasy.org. Viitattu 15.8.2018.
- ↑ ENZYME entry 1.3.8.2 enzyme.expasy.org. Viitattu 15.8.2018.
- ↑ HADHA uniprot.org. Viitattu 15.8.2018.
- ↑ HADHB uniprot.org. Viitattu 15.8.2018.
- ↑ a b K Shim, S Jacobi, J Odle, X Lin: Pharmacologic activation of peroxisome proliferator-activating receptor-α accelerates hepatic fatty acid oxidation in neonatal pigs. Oncotarget, 8.5.2018, 9. vsk, nro 35, s. 23900–23914. PubMed:29844861 doi:10.18632/oncotarget.25199 ISSN 1949-2553 Artikkelin verkkoversio.
- ↑ T Hu et al.: Hepatic Peroxisomal Fatty Acid β-Oxidation Is Regulated by Liver X Receptor α. Endocrinology, joulukuu 2005, 146. vsk, nro 12, s. 5380–5387. PubMed:16123164 doi:10.1210/en.2005-0591 ISSN 0013-7227 Artikkelin verkkoversio.
- ↑ PA Watkins, JM Ellis: Peroxisomal acyl-CoA synthetases. Biochimica et Biophysica Acta, syyskuu 2012, 1822. vsk, nro 9, s. 1411–1420. PubMed:22366061 doi:10.1016/j.bbadis.2012.02.010 ISSN 0006-3002 Artikkelin verkkoversio.
- ↑ HK Delille, NA Bonekamp, M Schrader: Peroxisomes and Disease - An Overview. International Journal of Biomedical Science : IJBS, joulukuu 2006, 2. vsk, nro 4, s. 308–314. PubMed:23674998 ISSN 1550-9702 Artikkelin verkkoversio.
- ↑ a b c d Y Ren, H Schulz: Metabolic functions of the two pathways of oleate beta-oxidation double bond metabolism during the beta-oxidation of oleic acid in rat heart mitochondria. The Journal of Biological Chemistry, 3.1.2003, 278. vsk, nro 1, s. 111–116. PubMed:12397064 doi:10.1074/jbc.M209261200 ISSN 0021-9258 Artikkelin verkkoversio.
- ↑ E Volodina, A Steinbüchel: (S)-3-hydroxyacyl-CoA dehydrogenase/enoyl-CoA hydratase (FadB’) from fatty acid degradation operon of Ralstonia eutropha H16. AMB Express, 28.8.2014, nro 4, s. 69. PubMed:25401070 doi:10.1186/s13568-014-0069-0 ISSN 2191-0855 Artikkelin verkkoversio.
- ↑ a b EA Emken: Nutrition and biochemistry of trans and positional fatty acid isomers in hydrogenated oils. Annual Review of Nutrition, 1984, nro 4, s. 339–376. PubMed:6432011 doi:10.1146/annurev.nu.04.070184.002011 ISSN 0199-9885 Artikkelin verkkoversio.
- ↑ a b T Silverstein: The mitochondrial phosphate-to-oxygen ratio is not an integer. Biochemistry and Molecular Biology Education, marraskuu 2005, 33. vsk, nro 6, s. 416–417. PubMed:21638612 doi:10.1002/bmb.2005.49403306416 ISSN 1470-8175 Artikkelin verkkoversio.