Atomi
| Atomi | ||||||||
|---|---|---|---|---|---|---|---|---|

| ||||||||
| Taiteellinen näkemys yhdestä helium-atomista. Tumma ja hälvenevä kohta kuvaa elektronipilveä, josta todennäköisimmin on heliumin kaksi elektronia. Mitä tummempi kohta on, sitä todennäköisemmin elektroni on siellä. Suurennettu kohta kuvaa atomin ydintä, jossa sijaitsevat kaksi protonia (vaaleanpunaiset) ja kaksi neutronia (violetti). | ||||||||
| Määritelmä | ||||||||
| ||||||||
| Ominaisuudet | ||||||||
|
Atomi (m.kreik. ἄτομος, atomos, jakamaton) on alkuaineen kemiallisesti pienin osa.[2] Toisin kuin sanan alkuperäinen merkitys antaa ymmärtää, nykyisin atomien katsotaan koostuvan pienemmistä osista.
Rakenne
[muokkaa | muokkaa wikitekstiä]Atomi jaetaan positiivisen varautuneeseen ytimeen ja ytimen ympärillä oleviin elektroneihin, jotka ovat negatiivisesti varautuneita.[2] Ydin koostuu protoneista ja neutroneista. Atomissa on sama määrä protoneita ja elektroneja.
Protonit ja neutronit ovat massaltaan moninkertaisesti elektroneja suurempia, ja atomin massa onkin pitkälti keskittynyt ytimeen. Elektronien kulloistakin todennäköistä sijaintia kuvataan teoreettisella todennäköisyysjakaumalla. Tätä aluetta, missä elektroni voi teoreettisesti sijaita, kutsutaan myös elektronipilveksi, -verhoksi tai -kuoreksi. Ytimen ja elektronipilven väliin jää täysin tyhjää tilaa ja suurin osa atomin tilavuudesta onkin tyhjää.[2][3]
Atomin todellista rakennetta on hankala kuvata täsmällisesti, ja atomia kuvatessa joudutaan käyttämään eri tasoisia malleja, jotka antavat atomista suurpiirteisen ja yksinkertaistetun kuvan. Rutherfordin atomimallissa elektroni kuvataan kiertämään tiettyä, usein pyöreää rataa, vaikka todellisuudessa tarkkaa rataa ei voi laskea. Ytimen ja elektroniverhon välinen etäisyys joudutaan kuvaamaan hyvin yksinkertaisesti, sillä jos atomin ydin olisi marmorikuulan kokoinen, elektroni sijaitsisi 50 metrin päässä.
Ydin
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Atomiydin
Atomin ydin sijaitsee keskellä atomia ja on varaukseltaan positiivinen. Ydin muodostuu nukleoneista: positiivisesti varautuneista protoneista (p+) ja varauksettomista neutroneista (n0). Eri alkuaineissa ytimessä on eri määrä nukleoneja. Ytimessä sijaitsevien hiukkasten lukumäärää sanotaan massaluvuksi.[4]
Saman alkuaineen kaikissa atomeissa on yhtä monta protonia. Protonien lukumäärä on samalla alkuaineen järjestysluku jaksollisessa järjestelmässä.[5] Saman alkuaineen atomeilla voi kuitenkin olla eri määrä neutroneja ja sen mukaisesti eri massaluku. Tällä tavalla toisistaan eroavia atomeja sanotaan alkuaineen eri isotoopeiksi. Saman alkuaineen eri isotooppien kemialliset ominaisuudet ovat samanlaisia, mutta ne voivat erota esimerkiksi radioaktiivisuutensa puolesta.[4]
Protonin ja neutronin on todettu koostuvan vielä pienemmistä osasista, kvarkeista. Protoni koostuu kahdesta ylös-kvarkista ja yhdestä alas-kvarkista. Neutroni vastaavasti kahdesta alas-kvarkista ja yhdestä ylös-kvarkista.[6]
Elektronipilvi
[muokkaa | muokkaa wikitekstiä]Atomiytimen ympärillä sijaitsee protoneihin nähden sama määrä elektroneja (e−), joiden todennäköistä sijaintia kuvastaa teoreettinen todennäköisyysjakauma. Elektronit eivät kulje ympyräradalla eivätkä edes jatkuvaa käyrää pitkin, niillä ei ole määriteltyä kulmanopeutta eikä hetkellistä nopeutta. Elektroni ei sanan varsinaisessa merkityksessä siten "liiku" tai "kierrä" lainkaan vaan "on olemassa" tietyssä pisteessä tietyllä hetkellä, todennäköisyydellä ja etäisyydellä atomiytimestä.[3]
Atomin ydin määrää siis alkuaineen, mutta elektroniverho sen, millaisia ioneja ja yhdisteitä voi syntyä. Elektroniverhossa ovat mahdollisia vain tietyt muutokset, jotka määräytyvät elektronien energiatilan mukaan. Kaikista vakaimmat ja vähiten reagoivat alkuaineet ovat jalokaasut, koska niillä on 8 elektronia uloimmalla kuorellaan[7], eli ne ovat oktetissa.
Elektronit jakaantuvat eri pääkvanttitasoille eli elektronikuorille. Kullakin tasolla on tietty pääkvanttiluku: 1, 2, 3, 4, 5, 6 ja 7, mutta näistä tasoista käytetään myös nimityksiä K-, L-, M-, N-, O-, P- ja Q-kuoret.[8] Elektroneja mahtuu ensimmäiselle eli K-tasolle vain kaksi kappaletta. Toiselle energiatasolle mahtuu 8 elektronia, kolmannelle tasolle 18 kappaletta, neljännelle 32 kappaletta, viidennelle 50 kappaletta, kuudennelle 72 kappaletta ja seitsemännelle 98 kappaletta. Q-taso on ytimestä katsottuna etäisin, jossa ei minkään nykyisin tunnetun alkuaineen atomilla ole perustilassa elektroneja. Elektronien maksimilukumäärä yhdellä energiatasolla voidaan laskea yksinkertaisella laskutoimituksella 2 · n², missä ’n’ korvataan tason järjestysluvulla.[8] Näin teoreettisesti kuvitteelliselle kahdeksannelle tasolle mahtuvat elektronit lasketaan 2 · 8² = 128, eli kahdeksannelle tasolle mahtuisi teoriassa 128 elektronia.
Ioneja muodostuu, kun atomi tai kemiallinen yhdiste luovuttaa tai ottaa vastaan yhden tai useamman elektronin.[9]
Kemiallisissa reaktioissa osa atomien elektroneista voi siirtyä myös kahden atomin yhteisille orbitaaleille. Tällä tavoin atomien välille syntyy kovalenttinen sidos, joka yhdistää atomit molekyyliksi. Kemialliset yhdisteet koostuvat yleensä joko tällä tavoin muodostuneista molekyyleistä tai positiivisista ja negatiivisista ioneista. Useat alkuaineetkin esiintyvät kahden tai useamman samanlaisen atomin muodostamina molekyyleinä.Matti Tiilikainen, Ilkka Virtamo: ”Kovalenttinen sidos”, Kemia 1, s. 33–37. WSOY, 1968. </ref>
Elektronipilven tarkempi rakenne
[muokkaa | muokkaa wikitekstiä]
Eri atomien elektronipilvet vaihtelevat elektronien määrästä riippuen, niitä voidaan kuvailla erilaisina atomin ympärillä olevina tilvauusmalleina, joissa elektronit todennäköisimmiten ovat. Kvanttimekaaninen atomimalli kuitenkin antaa tarkemman kuvauksen elektronien paikasta elektronipilvessä. Kvanttimekaaninen atomimalli lähtee ajatuksesta, että elektronin sijainnin määrää neljä tekijää: pääkvanttiluku n, sivukvanttiluku l, magneettinen kvanttiluku ml ja spin s.[3]
Jokainen elektronitaso eli pääkvanttiluku jakaantuu useisiin orbitaaleihin, joita erottavat toisistaan sivukvanttiluvun ja magneettisen kvanttiluvun eri arvot.
Kun pääkvanttiluku on n, sivukvanttiluvun mahdollisia arvoja ovat kokonaisluvut l välillä 0 ≤ l ≤ n. Sen jokaista arvoa kohti on annettu kirjainsymboli, jotka näkyvät taulukosta:[8]
| Sivukvanttiluku | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Kirjainsymboli | s | p | d | f |
Kun sivukvanttiluku saa arvon l, magneettisen kvanttiluvun mahdollisia arvoja ovat kokonaisluvut -l:stä l:ään, esimerkiksi sivukvanttiluvun ollessa 1 (p-orbitaalit) siis -1, 0 ja 1, ja sivukvanttiluvun ollessa 2 siis luvut -2, -1, 0, 1 ja 2.[8]
Jokaista pääkvanttilukua n kohti sivukvanttiluvulla on siis n mahdollista arvoa, joita kutakin vastaa tietty orbitaali. Esimerkiksi L-kuorella, jonka pääkvanttiluku on 1, sivukvanttiluku voi olla 0 tai 1, toisin sanoen sillä on sekä s-orbitaali ja p-orbitaali (p-orbitaaleja on kolme). Eri orbitaalit ovat eri muotoisia: S-orbitaalit on pallomaisia ja p-orbitaalit ovat muodoltaan kahdeksikkoja. P-orbitaaleja on aina kolme kullakin energiatasolla; jokaiselle ulottuvuudelle yksi. Eri p-orbitaaleja merkitään px-, py- ja pz-orbitaaleiksi. Yleensä erikseen merkitseminen on turhaa, sillä kaikki orbitaalit, joilla on sama pää- ja sivukvanttiluku, ovat samanenergisiä, ja ne ilmoitetaan yleensä ikään kuin ne muodostaisivat vain yhden orbitaalin.
Spin on yksi tärkeimmistä elektronin ominaisuuksista, kun mietitään atomin elektronikonfiguraatiota eli elektronien sijoittumista elektronipilveen. Spinin voidaan ajatella olevan tietynlaista elektronin pyörimistä. Elektronin pyörimistä ei pidä sekoittaa pyörimiseen, jonka ihminen havaitsee, vaan se on jotakin muuta. Jos elektronin pyöriminen akselinsa ympäri olisi vastaavaa kuin klassisen fysiikan ymmärtämä pyöriminen, elektroni pyörisi lähes kymmenkertaisella valonnopeudella akselinsa ympäri. Elektronin spin voi olla joko ½ tai −½.[10] Spin ilmoittaa ”pyörimissuunnan”.
Elektroneja sijoitetaan orbitaaleille kolmen säännön avulla: minimienergiaperiaatteen, Paulin kieltosäännön ja Hundin säännön avulla.[11] Alkuaineen järjestysluvun ja samalla elektronien lukumäärän kasvaessa eri orbitaalit täyttyvät seuraavassa järjestyksessä:[11]
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
Näissä merkinnöissä numerot tarkoittavat pääkvanttilukua, jäljessä olevat kirjaimet sivukvanttiluvun mukaan määräytyviä orbitaaleja. Huomattava on, että ylemmän kuoren s-orbitaalit täyttyvät ennen alemman kuoren d- ja f-orbitaaleja. Alkuaineet, joilla viimeksi tulleet elektronit ovat d-orbitaaleilla, ovat siirtymämetalleja. Alkuaineet, joilla ne ovat f-orbitaalilla, ovat lantanoideja tai aktinoideja.
Atomiteorian historia
[muokkaa | muokkaa wikitekstiä]- Pääartikkelit: Atomismi ja atomiteoria
Käsitteenä atomi on vanha. Jo Demokritos ehdotti, että kaikki koostuu "atomeista" ja tyhjyydestä, ja koska atomeissa ei ole tyhjyyttä, ne ovat jakamattomia, sillä ainoastaan tyhjyys voi erottaa kappaleet toisistaan.[12]
Kemiassa atomin käsitteen otti käyttöön John Dalton 1800-luvun alussa. Sen avulla hän selitti etenkin kerrannaisten painosuhteiden lain. Tämä laki sanoo, että jos kaksi alkuainetta muodostaa useampia yhdisteitä keskenään, niin ne määrät yhtä alkuainetta, jotka voivat yhtyä samaan määrään toista alkuainetta, ovat yksinkertaisessa, yleensä pienillä kokonaisluvuilla ilmaistavassa suhteessa toisiinsa.[13] Esimerkiksi 12 grammaa hiiltä voi yhtyä joko 16 grammaan happea muodostaen hiilimonoksidia tai tarkalleen kaksinkertaiseen määrään, 32 grammaan happea muodostaen hiilidioksidia. Tämä selittyy sillä, että hiilimonoksidin molekyylissä on yksi hiili- ja yksi happiatomi, hiilidioksidin molekyylissä taas yksi hiili- ja kaksi happiatomia.
Tämän teorian ja kemiallisten reaktioiden avulla pystyttiin jo 1800-luvun alkupuolella määrittämään varsin tarkoin eri alkuaineiden atomien massojen suhteet toisiinsa. Ei kuitenkaan vielä tiedetty, kuinka suuria niiden massat olivat gramman murto-osina, vain niiden suhteelliset massat tunnettiin. Siksi olikin otettava käyttöön erityinen atomimassayksikkö, joka alkujaan määriteltiin vetyatomin massaksi.[14] (Nykyisin se on määritelty 1/12-osaksi hiili-12-atomin massasta.[15]) Samoihin aikoihin kehittyivät nopeasti myös lämpöoppi ja siihen läheisesti liittyvä kineettinen kaasuteoria, joka myös edellytti kaasun koostuvat molekyyleistä. Kineettiseen kaasuteoriaan perustuva Avogadron laki osoittautui myös hyödylliseksi kaasumaisten alkuaineiden atomimassojen määrityksessä.[14]
1800-luvulla atomiteoria sai kuitenkin erityisen suuren merkityksen orgaanisessa kemiassa. Erilaisten kemiallisten reaktioiden avulla tehtiin pitkälle meneviä päätelmiä orgaanisten molekyylien rakenteesta ja siitä, missä järjestyksessä niissä atomit sijaitsevat toisiinsa nähden. Kun paljon myöhemmin orgaanisten molekyylien rakenteita pystyttiin tutkimaan myös röntgensäteiden avulla, kemistien tekemät päätelmät osoittautuivat useimmissa tapauksissa oikeiksi.[16]
Atomiteoria tuli nopeasti tieteilijöiden yleisesti hyväksymäksi, joskin epäilijöitä oli vielä 1800-luvun lopullakin, esimerkiksi Ernst Mach. Vasta radioaktiivisuutta koskevat tutkimustulokset sekä Albert Einsteinin vuonna 1905 esittämä Brownin liikkeen selitys ratkaisivat kiistan lopullisesti ja tekivät myös mahdollisiksi määrittää atomimassayksikön ja gramman välisen suhteen.[17]
Demokritoksen tavoin myös Dalton ja tiedeyhteisö vielä kauan hänen jälkeensäkin piti atomia jakamattomana. Elektrolyysin tutkimus johti kuitenkin vähitellen siihen päätelmään, että atomi voi saada sähkövarauksen eli ionisoitua, mikä antoi aihetta olettaa, että on olemassa atomiakin pienempiä sähköisesti varattuja hiukkasia.[18]
Atomimalleja
[muokkaa | muokkaa wikitekstiä]

Runsaat 2 000 vuotta sitten filosofi Platon esitteli teoksessaan Timaios eri alkuaineiden atomeja. Hän yhdisti jokaiseen klassiseen alkuaineeseen – maahan, ilmaan, tuleen ja veteen – säännöllisen monikulmion, niin kutsutun Platonin kappaleen, niin että maata vastasi kuutio, ilmaa oktaedri, vettä ikosaedri ja tulta tetraedri.[19] Platon ajatteli jokaisen alkuaineen koostuvan omanlaisistaan atomeista, kuten nykyteoriatkin olettavat.
Nykyisistä, tieteellisiin havaintoihin perustuvista atomimalleista ensimmäinen on elektronin löytäjän Joseph Thomsonin rusinapullamalli. Atomin oli havaittu olevan sähköisesti neutraali, mutta koostuvan erimerkkisesti varautuneista hiukkasista. Klassisen teorian mukaan ainoa mahdollinen pysyvä atomimalli oli sellainen, jossa positiiviset ja negatiiviset hiukkaset ovat tasaisesti levittyneet atomiin kuin rusinat pullaan.[20]
Ernest Rutherford teki kuitenkin kokeen, jossa hän pommitti ohutta kultakalvoa alfahiukkasilla. Suureksi yllätyksekseen hän havaitsi, että pieni osa hiukkasista kimposi kalvosta takaisin muiden mennessä läpi, ikään kuin suurin osa atomista olisi tyhjää täynnä ja vain pieni ydin sisältäisi kaiken massan. Rutherford päätyi aurinkokuntamalliin, jossa elektronit kiertävät positiivista ydintä samaan tapaan kuin planeetat aurinkoa. Rutherfordin atomimallin mukainen atomi ei kuitenkaan klassisen fysiikan mukaan olisi vakaa, sillä ympyräliikkeessä olevat elektronit säteilisivät energiansa pian pois.[21]
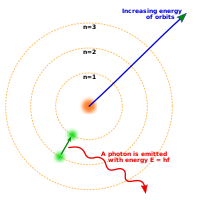
Niels Bohr ratkaisi ongelman esittämällä, että elektronit kiertävät ydintä vain tietyillä pysyvillä, stationaarisilla radoilla. Bohrin mallissa elektronit säteilevät vain siirtyessään radalta toiselle absorboimalla tai emittoimalla fotonin. Mallin heikkoudet liittyvät siihen, että se ei mitenkään selitä kvantittumista.[21] Lopulta fyysikot kuten Erwin Schrödinger saivat kehitettyä kvanttimekaanisen atomimallin, jossa elektronit muodostavat ytimen ympärille todennäköisyyspilviä: koskaan ei voi tietää varmasti, missä elektroni on, vaan se on ikään kuin levittäytynyt koko avaruuteen. Kvanttimekaniikan monimutkaisuuden ja järjenvastaisuuden vuoksi Rutherfordin ja Bohrin yksinkertaisia malleja käytetään edelleen opetuksessa[22], ja useimmat ihmiset ajattelevatkin atomeja edelleen pieninä aurinkokuntina. Kvanttimekaaninen atomimalli on kuitenkin todistettu päteväksi useilla äärimmäisen tarkoilla kokeilla.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Champion, Matthew: ”Re: How many atoms make up the universe?”, 1998
- ↑ a b c Atom | Definition, Structure, History, Examples, Diagram, & Facts | Britannica www.britannica.com. Viitattu 16.1.2023. (englanniksi)
- ↑ a b c Milton Orchin ym.: Atomic Orbital Theory. Wiley-Interscience. Teoksen verkkoversio. (englanniksi)
- ↑ a b Matti Tiilikainen, Ilkka Virtamo: ”Alkuaineet, Isotoopit”, Kemia 1, s. 3–4. WSOY, 1968.
- ↑ Matti Tiilikainen, Ilkka Virtamo: ”Alkuaineiden jaksollinen järjestelmä”, Kemia 1, s. 18. WSOY, 1968.
- ↑ Kvarkki Turun yliopisto. Arkistoitu 27.9.2022. Viitattu 13.9.2023.
- ↑ Matti Tiilikainen, Ilkka Virtamo: ”Atomien elektroniparvet: Atomiorbitaalit”, Kemia 1, s. 15. WSOY, 1968.
- ↑ a b c d Leena Lahti: ”Elektronikonfiguraatiot”, Kvanttifysiikka, s. 106–107. (3. painos) Gaudeamus, 1977. ISBN 951-662-086-8
- ↑ Matti Tiilikainen, Ilkka Virtamo: ”Atomien ionisoituminen”, Kemia 1, s. 22–24. WSOY, 1968.
- ↑ Leena Lahti: ”Elektronin spin”, Kvanttifysiikka, s. 102–104. (3. painos) Gaudeamus, 1977. ISBN 951-662-086-8
- ↑ a b Kvanttimekaaninen atomimalli tomusokeritemppu.files.wordpress.com. Viitattu 13.9.2023.
- ↑ John Hudson: Suurin tiede – kemian historia, s. 23–24. Suomentanut Kimmo Pietiläinen. Art House, 2002. ISBN 951-884-346-5
- ↑ John Hudson: Suurin tiede – kemian historia, s. 130. Suomentanut Kimmo Pietiläinen. Art House, 2002. ISBN 951-884-346-5
- ↑ a b ”Atomiteoria”, Tietosanakirja, 1. osa (A–Confort), palsta 690. Tietosanakirja Oy, 2012. Teoksen verkkoversio.
- ↑ Valtioneuvoston asetus mittayksiköistä (1015/2014), 8 § Finlex. Valtioneuvosto. Viitattu 13.9.2023.
- ↑ Richard P. Feynman: Suhteellisen helppoa, seitsemän lukua fysiikkaa. Suomentanut Kimmo Pietiläinen. Ursan julkaisuja n:o 82, 2002. ISBN 952-5329-18-6
- ↑ John Hudson: Suurin tiede – kemian historia, s. 311–312. Suomentanut Kimmo Pietiläinen. Art House, 2002. ISBN 951-884-346-5
- ↑ ”Atomit ja molekyylit”, Otavan iso Fokus, 1. osa (A–El), s. 239. Otava, 1973. ISBN 951-1-00273-2
- ↑ Bertrand Russel: ”Platonin kosmogonia”, Länsimaisen filosofian historia, 1. osa, s. 168. Suomentanut J. A. Hollo. WSOY, 1948.
- ↑ Atomimallien kehittyminen Oulun yliopisto. Viitattu 13.9.2023.
- ↑ a b Atomin rakenteen historia Helsingin yliopisto. Viitattu 13.9.2023.
- ↑ Bohrin atomimalli Kemia 2: Kemian mikromaailma. Viitattu 13.9.2023.
Kirjallisuutta
[muokkaa | muokkaa wikitekstiä]- Ball, Philip: Kemian eturintamassa: Matka molekyylien maailmaan. (Designing the molecular world: Chemistry at the Frontier, 1994) Suomentanut Kimmo Pietiläinen. Helsinki: Terra Cognita, 1997. ISBN 952-5202-07-0
- Krauss, Lawrence M.: Atomi: Matka maailmankaikkeuden alusta elämän syntyyn ja siitä edelleen. (Atom: An Odyssey from the Big Bang to life on Earth...and beyond, 2001) Suomentanut Juha Pietiläinen. Helsinki: Terra Cognita, 2002. ISBN 952-5202-51-8
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Atomi Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Atomi Wikimedia Commonsissa
- Opetus TV: Atomi
- Hiukkasseikkailu (Arkistoitu – Internet Archive)
Alkeishiukkaset | |||||
|---|---|---|---|---|---|
| Fermionit | |||||
| Bosonit |
| ||||
| Hypoteettiset |
| ||||
| Yhdistelmähiukkaset | |||||
| Hadronit |
| ||||
| Muut | Atomi · Atomiydin · Dikvarkki · Eksoottinen atomi (Positronium · Myonium · Tauonium) · Molekyyli · Pentakvarkki · Tetrakvarkki | ||||
| Hiukkaslöytöjen aikajana | |||||