Volframi
| |||||
| Yleistä | |||||
| Nimi | volframi | ||||
| Tunnus | W | ||||
| Järjestysluku | 74 | ||||
| Luokka | siirtymämetalli | ||||
| Lohko | d | ||||
| Ryhmä | 6, siirtymäalkuaine | ||||
| Jakso | 6 | ||||
| Tiheys | 19,25 · 103 kg/m3 | ||||
| Kovuus | 7,5 (Mohsin asteikko) | ||||
| Väri | hopeanvalkoinen | ||||
| Löytövuosi, löytäjä | 1783, Juan José ja Fausto Elhuyar | ||||
| Atomiominaisuudet | |||||
| Atomipaino (Ar) | 183,84[1] | ||||
| Atomisäde, mitattu (laskennallinen) | 135 (193) pm | ||||
| Kovalenttisäde | 146 pm | ||||
| Orbitaalirakenne | [Xe] 4f14 5d4 6s2 | ||||
| Elektroneja elektronikuorilla | 2, 8, 18, 32, 12, 2 | ||||
| Hapetusluvut | +IV, +V, +VI | ||||
| Kiderakenne | tilakeskinen kuutiollinen (body centered cubic, BCC) | ||||
| Fysikaaliset ominaisuudet | |||||
| Olomuoto | kiinteä | ||||
| Sulamispiste | 3 683,15 K (3 410 °C) | ||||
| Kiehumispiste | 6 203[2] K (5 930 °C) | ||||
| Moolitilavuus | 9,47 · 10−6 · 10−3 m3/mol | ||||
| Höyrystymislämpö | 8,8 kJ/mol | ||||
| Sulamislämpö | 192 kJ/mol | ||||
| Höyrynpaine | 4,27 Pa 3680 K:ssa | ||||
| Äänen nopeus | 5 174 m/s 293,15 K:ssa | ||||
| Muuta | |||||
| Elektronegatiivisuus | 1,7 (Paulingin asteikko) | ||||
| Ominaislämpökapasiteetti | 0,132 kJ/(kg K) | ||||
| Sähkönjohtavuus | 2 · 107 S/m | ||||
| Lämmönjohtavuus | 173 W/(m·K) | ||||
| CAS-numero | 7440-33-7 | ||||
| Tiedot normaalilämpötilassa ja -paineessa | |||||
Volframi on hopeanvalkea metallinen alkuaine, jonka kemiallinen merkki on W (lat. wolframium). Volframilla on viisi pysyvää isotooppia. Volframi ei ole kovin myrkyllistä; tosin metallipöly ärsyttää ihoa ja silmiä.
Volframin englanninkielinen nimi on tungsten, joka tulee ruotsin kielen sanoista tung (raskas) ja sten (kivi). Volframi on varsin kovaa ja tiheää sekä kestää hyvin kulutusta ja lämpöä, minkä myötä sitä käytetään näitä ominaisuuksia vaativissa kohteissa, kuten kovametalliseoksissa. Suuren tiheytensä myötä se on myös yleinen materiaali panssarintorjunta-ammuksissa.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]
Ominaisuuksiltaan volframi on kova ja tiheä. Kovuutensa takia sitä käytetään paljon metalliseoksissa. Puhtaana alkuaineena se on sitkeä, mutta alhaisissa lämpötiloissa se on kuitenkin hauras.[3] Väriltään volframi on hopeanvalkoinen, mutta tummuu ilmassa, koska se muodostaa suojaavan oksidikerroksen. Jauheena se on harmaata. Volframilla on kaikista metalleista korkein sulamispiste, korkein kiehumispiste[2] ja suurin vetolujuus. Tämän lisäksi sillä on myös korkea lämmönjohtokyky ja korroosion kestokyky.[3]
Yhdisteissä se on kaikkein yleisimmin hapetusluvulla VI. Volframi on yksi viidestä tärkeimmästä tulenkestävästä metallista (muut ovat niobium, molybdeeni, tantaali ja renium). Näitä metalleja yhdistävät suuri kulumisen ja lämmön kestokyky.[3]
Sen lisäksi, että volframi on haurasta alhaisissa lämpötiloissa, käyttöä rajoittavat uudelleenkiteytymisestä johtuva hauraus ja säteilyn aiheuttamat vauriot. Seostamalla voidaan kuitenkin parantaa volframin ominaisuuksia. Esimerkiksi tantaalia, titaania, vanadiinia ja molybdeenia käytetään parantamaan volframin mekaanisia ominaisuuksia.[4]
Historia
[muokkaa | muokkaa wikitekstiä]Vuonna 1781 Carl Wilhelm Scheele keksi, että uutta volframihappoa voisi tehdä scheeliitistä. Scheele ja Torbern Bergman ehdottivat, että happoa pelkistämällä voisi löytyä uusi metalli. Vuonna 1783 veljekset Juan José ja Fausto Elhuyar analysoivat tinakaivoksesta otettua wolframiittinäytettä ja huomasivat sen olevan uuden hapon rauta- ja mangaanisuola. Veljekset huomasivat wolframiitista tehdyn hapon olevan samanlaista volframihapon kanssa. Myöhemmin samana vuonna veljekset onnistuivat valmistamaan puhdasta volframia pelkistämällä tätä happoa kivihiilellä.[5]
1847 Robert Oxlandille myönnettiin patentti, johon sisältyi natriumvolframaatin valmistaminen, volframihapon muodostuminen ja metalliseen muotoon pelkistäminen öljyllä, tervalla tai hiilellä. Tämä merkitsi suurta askelta modernissa volframikemiassa ja avasi ovia teollistumiseen.[6]
Toisen maailmansodan aikaan volframia tuottavat valtiot joutuivat molempien sodan osapuolien painostuksen alaiseksi, sillä volframikarbidi oli kovuutensa ansiosta laajalti käytössä leikkuutyökaluissa. Volframilla vahvistettu teräs oli myös tärkeä hyödyke.[7]
Esiintyminen
[muokkaa | muokkaa wikitekstiä]Volframia esiintyy wolframiitissa (Fe,Mn)WO4, joka on ferberiitin FeWO4 ja hübneriitin MnWO4 kiinteä seos, sekä scheeliitissä CaWO4.[8] Luonnossa volframi ei esiinny puhtaana alkuaineena vaan se on aina yhdisteenä. Malmeista volframi saadaan pelkistämällä niissä esiintyvä volframioksidi vedyn ja hiilen avulla. Volframilla on 33 isotooppia. Isotooppien massaluvut ovat väliltä 158–190.
Luonnossa esiintyvä volframi on sekoitus viidestä näistä isotoopeista seuraavien suhteiden mukaan: 180W (0,1 %), 182W (26,5 %), 183W (14,3 %), 184W (30,6 %) ja 186W (28,4 %).[3]
Valmistus
[muokkaa | muokkaa wikitekstiä]Volframia tuotetaan maailmalla yhteensä vuosittain noin 60 000–80 000 tonnia, esimerkiksi vuonna 2012 maailman volframin tuotanto oli 76 400 tonnia. Ylivoimaisesti suurin volframia tuottava valtio on Kiina, joka tuottaa vuosittain yli 80 prosenttia tuotetusta volframista. Lisäksi volframia tuottavat esimerkiksi Venäjä, Kanada, Bolivia, Vietnam ja Portugali. Myös Kongossa tuotetaan volframia, minkä vuoksi volframimineraaleja pidetään konfliktimineraalina. Myös Yhdysvalloissa tuotetaan volframia, mutta tuotannon määrää ei tiedetä.[9][10]
Volframia tuotetaan louhituista malmeista ja prosessi vaatii monta vaihetta, jotka on eritelty kuvassa 2.
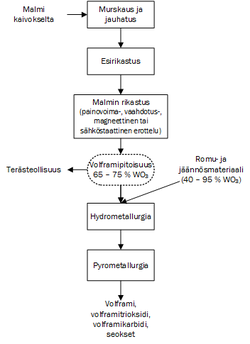
Aluksi louhittu malmi murskataan ja jauhetaan. Saadusta jauheesta erotetaan fotometrisesti tai UV-fluoresenssin ja paineilman avulla ensin enimmät kuona-aineet pois. Sen jälkeen on lisärikastusvaihe, jonka seurauksena seoksen volframipitoisuus on 65–75 %. Lopuksi käytetään hydrometallurgiaa ja pyrometallurgiaa, joiden seurauksena saadaan joko puhdasta volframia tai sen seoksia, esimerkiksi volframitrioksidia tai -karbidia. Metallurgioissa käytetään hyväksi erilaisia hiilen ja vedyn pelkistysreaktioita. Volframia voidaan valmistaa myös pelkistämällä volframitrioksidia.[11]
Lisäksi volframia kierrätetään paljon, sillä se on hyvin arvokasta ja sen tuottaminen on pitkä prosessi. Kierrätyksessä käytetään apuna sinkkiä.[11]
Käyttökohteet
[muokkaa | muokkaa wikitekstiä]
Suurin käyttökohde volframille ovat kovametallit, joissa volframikarbideja käytetään materiaalin lujittamiseen. Volframia käytetään myös seosaineena teräksissä sekä sitä hyödynnetään erilaisissa elektroniikan ja kemian sovelluksissa.
Kovametallit
[muokkaa | muokkaa wikitekstiä]Volframikarbidi (WC) on yksi kovimmista karbideista ja se onkin käytetyin materiaali kovametallien valmistuksessa. Kovametalleissa volframikarbidi on partikkeleina matriisissa, joka koostuu tyypillisimmin koboltti- tai nikkeliseoksesta. Karbidipartikkelit tuovat materiaalille suuren lujuuden ja kovuuden, metallinen matriisi sitkeyden. Kovametalleita käytetään erityisesti työstökoneiden terissä niiden hyvien mekaanisten ominaisuuksien takia. Volframikarbideja voidaan käyttää myös kovien, kulutuksenkestävien pinnoitteiden valmistuksessa. WC-pinnoitteet ovat termisesti hyvin stabiileja ja suojaavat materiaalia hapettumiselta.[12] Volframia ja volframikarbidia käytetään myös sormuksien valmistuksessa, erityisesti kestävyyssyistä.[13]
Terässeokset
[muokkaa | muokkaa wikitekstiä]Volframia käytetään seosaineena työkaluteräksissä, sillä se tekee materiaalista kovempaa ja sallii suuremmat kierrosnopeudet. Volframia käytetään kuuma- ja kylmätyöstöteräksissä sekä pikateräksissä ja seosmäärät vaihtelevat 0,5 prosentista jopa 20 prosenttiin. Volframi kestää myös erittäin hyvin virumista ja se on termisesti stabiili, joten sitä käytetään seosaineena teräksissä, joiden tulee kestää korkeita lämpötiloja. Volframia käytetään seosaineena myös joissakin ruostumattomissa teräksissä.[12]
Elektroniikka- ja sähköteollisuus
[muokkaa | muokkaa wikitekstiä]Volframin hyvien sähköisten ominaisuuksien ansiosta sitä käytetään laajasti erilaisissa sovelluksissa. Volframia on käytetty pitkään hehkulamppujen hehkulankoina, koska sillä on korkea sulamispiste sekä matala höyrystymispaine, korkea lujuus ja hyvä virumisenkesto korkeissakin lämpötiloissa. Nykyisin hehkulamput on pitkälti korvattu energiansäästölampuilla, joissa voidaan käyttää volframia elektrodeina.
Volframia käytetään elektronilähteinä mm. elektronimikroskoopeissa. Alhainen höyrystymispaine korkeissakin lämpötiloissa tarjoaa lisäksi edellytykset moniin sovelluksiin. Teollisuudessa volframia käytetään muun muassa uuneissa kuumennuskäämeinä ja varauksenkuljettajina.[12]
Aurinkokennoissa voidaan käyttää volframidiselenidi-ohutkalvopinnoitteita (WSe2). Volframia käytetään myös ns. älyikkunoissa. Ikkunassa on ohut volframikerros, joka aktivoituu, kun sähkövirta kytketään päälle. Ilman virtaa ikkuna näyttää kirkkaalta, mutta kun virta on päällä volframikerros tummentaa ikkunan. Älyikkunoilla voidaan saavuttaa huomattavia energiansäästöjä erityisesti lämpimissä maissa, joissa niitä voidaan käyttää ilmastointilaitteiden sijasta.[14]
Kemianteollisuus
[muokkaa | muokkaa wikitekstiä]Tyypillisin kemian alan käyttökohde volframille ovat katalyytit. Öljyteollisuudessa volframikatalyyttejä hyödynnetään useissa eri tuotantovaiheissa. Lisäksi volframia käytetään väri- ja voiteluaineissa.[14]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Michael T. Wieser & Tyler B. Coplen: Atomic Weights of the Elements 2009 (IUPAC technical report). Pure and Applied Chemistry, 2011, 83. vsk, nro 2. IUPAC. Artikkelin verkkoversio. Viitattu 16.4.2011. (englanniksi)
- ↑ a b Zhang, Yiming: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. Journal of Chemical & Engineering Data, 11.1.2011, 56. vsk. Artikkelin verkkoversio.
- ↑ a b c d Tungsten www.chemicool.com. Viitattu 9.6.2017. (englanniksi)
- ↑ Wen-Li Yan, Hong-Bo Zhou, Shuo Jin, Ying Zhang, Guang-Hong Lu: Dissolution energetics and its strain dependence of transition metal alloying elements in tungsten. Journal of Nuclear Materials, 1.1.2015, nro 456, s. 260–265. doi:10.1016/j.jnucmat.2014.09.045 Artikkelin verkkoversio.
- ↑ International Tungsten Industry Association, Newsletter, 2005 (englanniksi) web.archive.org.
- ↑ History of Tungsten, International Tungsten Industry Association, 2011 (englanniksi) itia.info.
- ↑ Stevens, Donald G.: World War II Economic Warfare: The United States, Britain, and Portuguese Wolfram. The Historian, 22.3.1999, nro 3. ISSN 0018-2370 Artikkelin verkkoversio. (englanniksi)
- ↑ Tungsten: Tungsten mineral information and data. www.mindat.org. Viitattu 9.6.2017.
- ↑ Tungsten: World Concentrate Production, By Country www.indexmundi.com. Viitattu 9.6.2017.
- ↑ Nicholas D. Kristof: Death by Gadget in Congo The New York Times. 26.6.2010. Viitattu 9.6.2017. (englanniksi)
- ↑ a b Tungsten: extraction and processing-Metalpedia metalpedia.asianmetal.com. Viitattu 9.6.2017.
- ↑ a b c Tungsten Applications | International Tungsten Industry Association (ITIA) www.itia.info. Viitattu 9.6.2017.
- ↑ Miesten sormukset — kattava opas trendhim.fi. Viitattu 12.10.2020.
- ↑ a b J. Christian, R. P. Singh Gaur, T. Wolfe and J. R. L. Trasorras, Tungsten Chemicals and their Applications, Global Tungsten and Powders Corp., Towanda, PA, USA, 2011 (englanniksi) almonty.com.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Volframin kansainvälinen kemikaalikortti
- Periodictable: Technical data for Tungsten (englanniksi)
- Webmineral: Mineral Species containing Tungsten (W) (englanniksi)
- Mindat: The Mineralogy of Tungsten (englanniksi)
- Luettelo volframin isotoopeista The Isotopes Project Home Page (englanniksi)
- Dr. Duke's Phytochemical and Ethnobotanical Databases: Tungsten (englanniksi)
- The Royal Society of Chemistry (RSC): Tungsten (englanniksi)
- PeriodicTable: Tungsten (W) (englanniksi)
- PubChem: Tungsten (englanniksi)
- Human Metabolome Database (HMDB): Tungsten (englanniksi)
- Food Component Database (FooDB): Tungsten (englanniksi)
