Uraanitetrakloridi
| Uraanitetrakloridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| IUPAC-nimi | Uraani(IV)kloridi |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | UCl4 |
| Moolimassa | 379,84 g/mol |
| Ulkomuoto | tummanvihreä kiteinen aine[1] |
| Sulamispiste | 590 °C (863 K)[1][2] |
| Kiehumispiste | 791 °C (1 064 K)[1][2] |
| Tiheys | 4,725[1] |
| Liukoisuus veteen | liukenee hyvin (hajoaa)[1] |
Uraanitetrakloridi eli uraani(IV)kloridi (molekyylikaava UCl4) on uraanin kloridi. Se muodostaa huoneenlämpötilassa tummanvihreitä kiteitä.[1] Yhdiste on erittäin hygroskooppista, ja se liukenee hyvin veteen, jossa se hydrolysoituu täysin alle 100 °C lämpötilassa, sekä useisiin polaarisiin orgaanisiin liuottimiin.[3] Yhdistettä täytyy käsitellä kuivassa tilassa ja se muuttuu ilman vaikutuksesta triuraanioktaoksidiksi U3O8 600 °C lämpötilassa.[3]
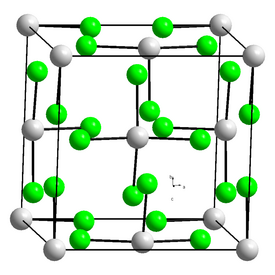
Uraanitetrakloridin kiderakenne on oktagonaalinen[1] ja muodostuu kahdesta tetragonaalisesta osasta. Rakenne on samanlainen kuin muiden aktinoidien tetraklorideilla;[3] U4+-ionilla on naapurina kahdeksan kloridi-ionia, neljä 287 pm ja toiset neljä 264 pm etäisyydellä.[4]
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]Yhdistettä voidaan valmistaa uraanitrioksidin UO3 reaktiolla heksaklooripropeenin CCl3CCl=CCl2 kanssa:[1]
- UO3 + 3 CCl3CCl=CCl2 → UCl4 + Cl2 + 3 CCl2=CClOCl
Tyypillinen valmistustapa teollisessa mittakaavassa on hiilitetrakloridin reaktio uraanidioksidin UO2 kanssa 370 °C lämpötilassa:[3]
- UO2 + CCl4 → UCl4 + CO2
Metallista uraania voidaan valmistaa pelkistämällä uraanitetrakloridia kaliumilla,[5] kalsiumilla tai magnesiumilla.[6] Tosin usein uraanimetallin valmistukseen käytetään mieluummin stabiilimpaa uraanitetrafluoridia UF4, johtuen tetrakloridin hygroskooppisuudesta ja oksidikerroksen muodostumisesta.[6]
Uraanitetrakloridilla on käyttöä laajamittaisessa uraanin väkevöinnissä uraani-235-isotoopin valmistamiseksi.[7] Siitä valmistetaan myös lukuisia muita uraaniyhdisteitä esimerkiksi uraanitrikloridia.[3]
Lähteet
[muokkaa | muokkaa wikitekstiä]- Grenthe, Ingmar ym.: ”luku 5”, Uranium, s. 253–698. (Teoksessa: Morss, Lester R. ym. (toim.) The Chemistry of the Actinide and Transactinide Elements, 3. painos) Dordrecht: Springer, 2006. ISBN 1402035985 Teoksen verkkoversio (PDF). (englanniksi) (Arkistoitu – Internet Archive)
Viitteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h Perry, Dale L.: Handbook of Inorganic Compounds, s. 445–446. (2. painos) CRC Press, 2016. ISBN 9781439814628 Kirja Googlen teoshaussa (viitattu 26.1.2019). (englanniksi)
- ↑ a b Uranium: uranium tetrachloride Webelements.com. Viitattu 26.1.2019. (englanniksi)
- ↑ a b c d e Grenthe, s. 490–491
- ↑ Taylor, J. C. & Wilson, P. W.: A neutron-diffraction study of anhydrous uranium tetrachloride. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry, 1973, 29. vsk, nro 9, s. 1942–1944. doi:10.1107/S0567740873005790 ISSN 0567-7408 (englanniksi)
- ↑ Grenthe, s. 254
- ↑ a b Grenthe, s. 319
- ↑ Grenthe, s. 420
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- PubChem: Uranium(IV) Chloride (englanniksi)