Faasimuutos
Faasimuutos eli faasitransitio on epäjatkuvuuskohta aineen fysikaalisissa ominaisuuksissa ulkoisten tekijöiden kuten paineen tai lämpötilan funktiona. Tavanomaisia faasimuutoksia ovat muutokset kiinteän, nestemäisen, ja kaasumaisen olomuodon välillä.
Termodynamiikassa faasimuutokseen liittyy aina yhden tai useamman fysikaalisen suureen äkillinen muutos pienen ulkoisten tekijöiden muutoksen seurauksena. Esimerkiksi nesteen lämpötilan laskiessa sen sulamispisteen alapuolelle, neste jähmettyy äkillisesti ja voi kiteytyä.
Faasimuutoksia
[muokkaa | muokkaa wikitekstiä]- Kiinteästä nesteeksi: sulaminen
- Nesteestä kiinteäksi: jähmettyminen
- Nesteestä kaasuksi: höyrystyminen
- Kaasusta nesteeksi: tiivistyminen
- Kiinteästä kaasuksi: sublimoituminen
- Kaasusta kiinteäksi: härmistyminen
- Ferromagneettisen materiaalin muuttuminen paramagneettiseksi Curien lämpötilassa
- Suprajohtavuuden ilmeneminen tietyissä materiaaleissa tietyn lämpötilan alapuolella
- Kvanttikondensaatin muodostuminen bosoneista, esimerkiksi Bosen–Einsteinin kondensaatin muodostuminen nestemäisessä heliumissa.
Faasidiagrammi
[muokkaa | muokkaa wikitekstiä]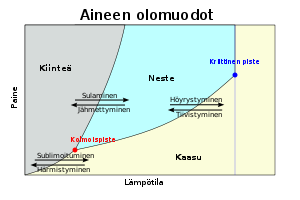
Faasidiagrammi on kuvaaja, jossa ilmenee aineen olomuotojen muutokset tietyssä lämpötilassa ja tietyssä paineessa suljetussa systeemissä. Faasidiagrammissa esiintyy kullekin aineelle ominaiset kriittinen piste ja kolmoispiste.[1]
Graafissa on kolme käyrää:
- Sulamispistekäyrä
- Kiehumispistekäyrä
- Sublimoitumiskäyrä
Luokittelu
[muokkaa | muokkaa wikitekstiä]Paul Ehrenfestin luokittelujärjestelmässä faasitransitiot luokitellaan vapaan energian analyyttisen rakenteen mukaan.[2] Ehrenfest-luokittelun mukaan faasitransitio on ensimmäistä kertalukua, mikäli vapaan energia on valitun termodynaamisen muuttujan suhteen on epäjatkuva, ja toista kertalukua, mikäli vapaan energian ensimmäinen derivaatta on epäjatkuva. Luokittelua voidaan jatkaa korkeampien derivaattojen avulla korkeampaan kertalukuun. Tämän luokittelun mukaan esimerkiksi neste-kaasu-transitio on ensimmäistä kertalukua, sillä vapaa energia on muutoksessa epäjatkuva. Suprajohteen faasitransitio puolestaan on toista kertalukua, sillä lämpökapasiteetti, vapaan energian derivaatta lämpötilan suhteen, on epäjatkuva.
Ehrenfest-luokittelu sallii myös ääretöntä kertalukua olevat jatkuvat faasitransitiot, joissa vapaan energian kaikki derivaatat ovat jatkuvia, mutta se ei ole analyyttinen transitiopisteessä. Kaksiulotteisissa systeemeissä tapahtuva topologinen Berezinski-Kosterlitz-Thouless-transitio kuuluu tähän luokkaan.[3]
Eksaktisti ratkaistavissa olevan kaksiulotteisen Ising-mallin faasitransitio ei kuitenkaan sovi Ehrenfest-luokitteluun, sillä sen lämpökapasiteetti ei ole epäjatkuva vaan divergoi logaritmisesti. Modernissa statistisessa fysiikassa käytetään tämän vuoksi yksinkertaisempaa luokittelua; faasitransitiot luokitellaan joko epäjatkuviksi tai jatkuviksi riippuen siitä, liittyykö muutokseen latenttilämpöä vai ei. Näihin kahteen luokkaan kuuluvia transitioita kutsutaan usein Ehrenfest-luokittelun mukaisesti ensimmäisen ja toisen kertaluvun faasitransitioiksi. Ising-mallin transitio on modernin luokittelun mukaan jatkuva, eli toista kertalukua.
Ensimmäisen kertaluvun transitioiden suhteen on mahdollista että faasimuutos ei pääse käynnistymään vaikka lämpötila ylittää faasirajan. Täten saadaan aikaan esimerkiksi alijäähtynyttä vettä. Tällöin vesi on nestemäisessä olomuodossa, vaikka lämpötila on alle sen sulamispisteen. Tällainen faasi on metastabiili ja faasimuutos saattaa käynnistyä yllättäen.
Jatkuvien faasitransitioiden teoria on hyvin tärkeässä osassa modernissa statistisessa fysiikassa, koska transitiopisteen lähettyvillä materiaalilla on monia ainutlaatuisia ominaisuuksia, kuten skaalainvarianssi (kritikaalisuus). Yksinkertaistettuna kritikaalisuus tarkoittaa, että systeemi "näyttää samalta" kaikilla pituusskaaloilla. Kritikaalisuudesta seuraa, että mikroskooppisesti hyvin erilaiset systeemit voivat käyttäytyä identtisellä tavalla faasitransition lähettyvillä. Jatkuvat faasitransitiot jaetaan universaliteettiluokkiin sen mukaan, mitä arvoja ns. kriittiset eksponentit saavat faasitransitiopisteessä. Kenties tärkein menetelmä kriittisten eksponenttien laskemiseen on renormalisaatioryhmä, jonka sovelluksista faasitransitioiden teoriassa Kenneth G. Wilson sai fysiikan Nobel-palkinnon vuonna 1982. Toisen kertaluvun transitioihin liittyy usein spontaani symmetriarikko.
Käytännön esimerkki ensimmäisen kertaluvun faasimuutoksesta
[muokkaa | muokkaa wikitekstiä]Jääpala on kattilassa, jota lämmitetään liedellä.
- Jääpalan lämpötila nousee, kunnes saavuttaa lämpötilan 0 °C ja osa jääpalasta sulaa.
- Veden lämpötila on 0 °C niin kauan kuin sulamatonta jäätä on jäljellä. Liedestä siirtyvä energia kuluu jään sulamiseen.
- Kun jääpala on täysin sulanut, liedestä vapautuva energia lämmittää vettä, kunnes veden lämpötila saavuttaa 100 °C, jolloin vesi alkaa höyrystyä.
- Veden lämpötila pysyy sadassa asteessa, liedestä siirtyvä energia kuluu veden höyrystymiseen.
Faasimuutoksen käyttöjä teknologiassa
[muokkaa | muokkaa wikitekstiä]- Metallivalu, teräksen karkaisu
- Jääkaappi
- Ilmastointilaite
- Lämpöpumppu
Faasimuutos fiktiivisessä kirjallisuudessa
[muokkaa | muokkaa wikitekstiä]Kurt Vonnegutin romaanissa Kissan kehto veden faasimuutos on keskeinen teema. Elämä maapallolla mullistuu, kun tieteilijä kehittää veden faasin, joka jäätyy lämpötilassa +45,8 °C.
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Zumdahl, Steven S. & Zumdahl, Susan A.: Chemistry, s. 479. (8. painos) Brooks Cole, 2008. ISBN 978-0-495-82992-8 (englanniksi)
- ↑ H. Eugene Stanley: Introduction to phase transitions and critical phenomena. New York: Oxford University Press, 1987. 15696711 ISBN 978-0-19-505316-6 Teoksen verkkoversio (viitattu 1.1.2022).
- ↑ J M Kosterlitz, D J Thouless: Ordering, metastability and phase transitions in two-dimensional systems. Journal of Physics C: Solid State Physics, 12.4.1973, nro 6, s. 1181–1203. doi:10.1088/0022-3719/6/7/010 ISSN 0022-3719 Artikkelin verkkoversio.