Ksantaatit
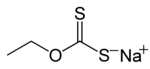

Ksantaatit ovat suoloja, joiden yleinen rakenne on muotoa ROCS2−M+. Tässä R on alkyyliryhmä, ja M+ joko Na+ tai K+. Ne ovat siis orgaanisia rikkiyhdisteitä.
Taustaa
[muokkaa | muokkaa wikitekstiä]Termi ksantaatti tulee kreikan sanasta ξανθός, xanthos, joka tarkoittaa keltaista tai kullanväristä. Suurin osa ksantaateista onkin keltaisia väriltään. Tanskalainen kemisti William Christopher Zeise löysi ja nimesi ne vuonna 1823. Ksantaatteja käytetään sellofaanin ja samanlaisten polymeerien kuten viskoosin valmistukseen selluloosasta, ja kaivosteollisuudessa vaahdotusrikastuksessa.[1] Niitä käytetään myös orgaanisen synteesin väliaineina.
Valmistus ja rakenne
[muokkaa | muokkaa wikitekstiä]Ksantaattisuoloja valmistetaan antamalla alkoholin, alkalimetallin (yleensä natrium tai kalium) ja hiilidisulfidin reagoida keskenään ksantaatioksi kutsutussa prosessissa.[1]
Alkalimetalli reagoi ensin alkoholin kanssa tuottaen nukleofiilisen alkoksidin, joka liittyy rikkihiilen CS2 elektrofiiliseen hiileen.[2]
Alkoksidi tuotetaan usein paikan päällä antamalla alkoholin reagoida väkevän emäksen kuten kaliumhydroksidin kanssa.
- ROH + CS2 + KOH → ROCS2K + H2O
Kaupallisesti merkittäviä ksantaatteja ovat mm. seuraavat:
- natriumetyyliksantaatti, CH3CH2OCS2Na
- kaliumetyyliksantaatti, CH3CH2OCS2K
- natriumisopropyyliksantaatti, (CH3)2CHOCS2Na
- natriumisobutyyliksantaatti, (CH3)2CHCH2OCS2Na
- kaliumamyyliksantaatti, CH3(CH2)4OCS2K
Reaktioita
[muokkaa | muokkaa wikitekstiä]
Ksantaattisuolat hajoavat happojen kanssa:
- ROCS2K + HCl → ROH + CS2 + KCl
Kyse on ksantaattien valmistusreaktion käänteisreaktiosta. Välivaiheena syntyy ksanthisia happoja, ROC(S)SH, jotka voidaan joskus erottaa.
Ksantaattianionit voivat myös alkyloitua, jolloin syntyy ksantaattiestereitä:[3]
- ROCS2K + R′X → ROC(S)SR′ + KX
Ne voidaan myös hapettaa ns. diksanthogeeneiksi:
- 2 ROCS2Na + Cl2 → ROC(S)S2C(S)OR + 2 NaCl
Ksantaatit sitoutivat siirtymämetallien kationeihin. Syntyvät varaukseltaan neutraalit kompleksit liukenevat orgaanisiin liuottimiin.[4]

Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b Kathrin-Maria Roy: Xanthates Ullmann's Encyclopedia of Industrial Chemistry. 2000. Wiley‐VCH. Viitattu 19.5.2021. (englanniksi)
- ↑ Yksityiskohtainen kuvaus reaktiosta kaliumetyyliksantaatin valmistuksessa: Price, Charles C.; Stacy, Gardner W.: p-Nitrophenyl sulfide. Organic Syntheses, 1948, 28. vsk, s. 82. doi:10.15227/orgsyn.028.0082
- ↑ Fabien Gagosz, Samir Z. Zard: A Xanthate-Transfer Approach to α-Trifluoromethylamines. Organic Syntheses, 1948, nro 84, s. 32. (englanniksi)
- ↑ Haiduc, I.: ”1,1-Dithiolato ligands”, Comprehensive Coordination Chemistry II, s. 349-376. Määritä julkaisija! (englanniksi)
- ↑ F. Galsbøl, C.E. Schäffer: Tris (O-Ethyl Dithiocarbonato) Complexes of Tripositive Chromium, Indium, and Cobalt. Inorganic Syntheses, 1967, nro 10, s. 42-49. doi:10.1002/9780470132418.ch6 (englanniksi)