Hydratsonit
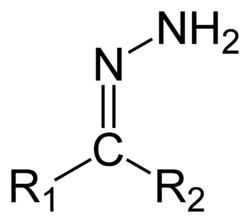
Hydratsonit ovat orgaanisia yhdisteitä, joille tunnusomainen funktionaalinen ryhmä on R1R2C=NNH2. Hydratsoneja valmistetaan tyypillisesti karbonyyliyhdisteen ja hydratsiinin tai hydratsiinijohdannaisen välisellä kondensaatioreaktiolla.[1][2]
Ominaisuudet ja reaktioita
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa hydratsonit ovat tyypillisesti keltaisia kiteisiä aineita. Alifaattiset hydratsonit ovat luonteeltaan voimakkaasti emäksisiä, kun taas aromaattiset hydratsonit ovat emäksinä heikompia. Hydratsonit hydrolysoituvat vesiliuoksessa neutraaleissa olosuhteissa vain hitaasti karbonyyliyhdisteeksi ja hydratsoniksi, mutta sekä hapot että emäkset katalysoivat tätä reaktiota. Hydratsonit voidaan pelkistää vedyttämällä hydratsiineiksi tai hapettaa atsiineiksi.[1][3][4]
Hydratsoneja esiintyy useissa orgaanisen kemian reaktioissa välituotteina tai intermediaatteina. Tällaisia reaktioita ovat muun muassa Fischerin indolisynteesi, karbonyyliyhdisteiden hiilivedyiksi pelkistämiseen käytettävä Wolff–Kishner-pelkistys ja Bamford–Stevens-reaktio, jossa tosyylihydratsonit muodostavat emäksisissä olosuhteissa alkeeneja.[1][3][4]
Hydratsonien synteesi
[muokkaa | muokkaa wikitekstiä]
Tyypillisin tapa valmistaa hydratsoneja on aldehydien tai ketonien ja hydratsiinin tai hydratsiinin mono- tai dialkyyli- tai -aryylijohdannaisen välinen kondensaatioreaktio. Aldehydit reagoivat ketoneja nopeammin. Aldehydit myös muodostavat ketoneja helpommin atsiineja erityisesti hydratsiiniylimäärän läsnä ollessa. Tämän vuoksi substituoimatonta hydratsiinia käytetään yleensä valmistettaessa hydratsoneja vain aromaattisista ketoneista. α-Dikarbonyyliyhdisteet ja hydroksiketonit tai -aldehydit kuten monosakkaridit muodostavat osatsonin, joissa on kaksi hydratsonille tyypillistä ryhmää vierekkäisissä hiiliatomeissa.[1][3][5] Aldehydit ja ketonit muodostavat helposti 2,4-dinitrofenyylihydratsoneja, jotka ovat kiinteitä yhdisteitä ja niitä käytetään aldehydien ja ketonien identifiointiin ja eristämiseen.
Hydratsoneja voidaan valmistaa myös oksiimeista hydratsonin avulla[5] ja β-ketohapoista tai β-ketoestereistä ja aromaattisista diatsoniumsuoloista Japp–Klingemann-reaktiolla[6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 703. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3
- ↑ Hydrazones IUPAC GoldBook. IUPAC. Viitattu 10.4.2015. (englanniksi)
- ↑ a b c Eugene F. Rothgery: Hydrazine and Its Derivatives, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2004. Viitattu 10.4.2015
- ↑ a b Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 232, 540. Oxford University Press, 2012. ISBN 978-0-19-927029-3 (englanniksi)
- ↑ a b Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, s. 1284–1285. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1 (englanniksi)
- ↑ Jie Jack Li: Name Reactions, s. 316. Springer, 2014. ISBN 978-3-319-03979-4 Kirja Googlen teoshaussa (viitattu 10.4.2015). (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Hydratsonit Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Hydratsonit Wikimedia Commonsissa
