1-propanoli
| Propanoli | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| Muut nimet | propyylialkoholi |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | C3H7OH |
| Moolimassa | 60,09 g/mol |
| Ulkomuoto | väritön neste |
| Sulamispiste | −126,5 °C |
| Kiehumispiste | 97,1 °C |
| Tiheys | 0,8034 g/cm3 |
| Liukoisuus veteen | liukenee täysin |
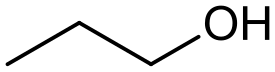
1-propanoli eli n-propanoli kuuluu alkoholien aineryhmään. 1-propanolin rakennekaava voidaan esittää muodossa CH3CH2CH2OH.
1-propanoli on normaaliolosuhteissa väritön, kirkas, helposti syttyvä ja palava neste. Sen moolimassa on 60,1 g/mol, kiehumispiste 97 °C, sulamispiste −127 °C, tiheys 0,80 g/cm3 (vesi = 1,0 g/cm3), leimahduspiste 15 °C, itsesyttymislämpötila 371 °C ja CAS-numero 71-23-8.
Yhdistettä esiintyy semiokemikaalina eliöiden viestinnässä.
1-propanoli on propanolin C3H7OH isomeerinen muoto.
1-propanoli reagoi voimakkaiden hapettimien, kuten perkloraattien ja nitraattien, kanssa, jolloin voi aiheutua palo- ja räjähdysvaara. Aineen reagoidessa maa-alkalimetallien, voimakkaiden pelkistimien ja nitridien kanssa reaktion tuloksena voi muodostua syttyviä ja/tai myrkyllisiä kaasuja.
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]1-propanolia muodostuu käymisen yhteydessä ja voidaan erottaa tislaamalla niin kutsutusta sikunaöljystä. Teollisesti sitä kuitenkin valmistetaan pääasiassa hydroformyloimalla eteeniä ja pelkistämällä näin syntynyt propanaali rodium- tai kobolttikatalyytin avulla 1-propanoliksi. Yhdistettä voidaan tuottaa myös propaania hapettamalla. Elektrolyysiä voidaan myös käyttää kuparikatalyytin avulla 1-propanolin tuotantoon hiilimonoksidista, mutta toistaiseksi matalalla hyötysuhteella.[2] 1-propanolin pääasiallinen käyttökohde on liuottimena käyttö. Yhdisteestä valmistetaan myös glykolieetteri-, propyyliasetaatti- tai propyylipropionaattijohdannaisia.[3][4][5]
Ilman korkeita tuotantokustannuksia 1-propanoli soveltuisi ottomoottoreissa käytettäväksi liikennepolttoaineeksi. Sen oktaaniluku (RON) on 118 ja energiasisältö 24 MJ/l – vain 20 % pienempi kuin bensiinillä.[6]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- 1-propanolin kansainvälinen kemikaalikortti
- OVA-ohje: 1-propanoli (Arkistoitu – Internet Archive)
Viitteet
[muokkaa | muokkaa wikitekstiä]- ↑ 1-Propanoli Käyttöturvallisuustiedote. 23.7.2018. Sigma Aldrich (Merck). Viitattu 3.9.2018.
- ↑ Shwartz, Mark: Stanford scientists discover a novel way to make ethanol without corn or other plants ("In the experiment, Kanan and Li found that a slightly altered oxide-derived copper catalyst produced propanol with 10 percent efficiency. The team is working to improve the yield for propanol by further tuning the catalyst's structure.") The Stanford News Service. 9.4.2014. Stanford, Kalifornia: Stanford University. Viitattu 23.4.2014. (englanniksi)
- ↑ Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 132. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3
- ↑ J. D. Unruh & D. Pearson: n-Propyl Alcohol, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000. Viitattu 13.04.2013
- ↑ Anthony J. Papa: Propanols, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2011. Viitattu 13.04.2013
- ↑ Bioalcohols ("Propanol is the forgotten alcohol fuel, but for good reason. Propanol is the most difficult and expensive alcohol to produce.") biofuel.org.uk. 2010. Arkistoitu 16.4.2014. Viitattu 23.4.2014. (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- PubChem: 1-Propanol (englanniksi)
- DrugBank: 1-Propanol (englanniksi)
- Human Metabolome Database: Propyl alcohol (englanniksi)
- ChemBlink: 1-Propanol (englanniksi)
- KEGG: 1-Propanol (englanniksi)
- Dr. Duke's Phytochemical and Ethnobotanical Databases: Propanol (englanniksi)
- Pherobase: Semiochemical – 3OH (englanniksi)


