Vaborbaktaami
| |
Vaborbaktaami
| |
| Systemaattinen (IUPAC) nimi | |
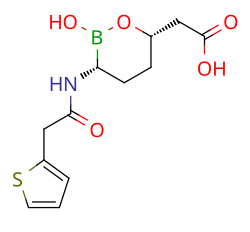
| 2-[(3R,6S)-2-hydroksi-3-[(2-tiofen-2-yyliasetyyli)amino]oksaborinan-6-yyli]etaanihappo | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | ? |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C12H16BNO5S |
| Moolimassa | 297,138 |
| SMILES | Etsi tietokannasta: , |
| Farmakokineettiset tiedot | |
| Hyötyosuus | ? |
| Proteiinisitoutuminen | 33 %[1] |
| Metabolia | ei metaboloidu |
| Puoliintumisaika | noin 2 tuntia[1] |
| Ekskreetio | renaalinen |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | intravenoosi |
Vaborbaktaami (C12H16BSNO5) on boronihappojohdannaisiin kuuluva orgaaninen yhdiste. Yhdistettä käytetään yhdessä karbapeneemien kanssa muille antibiooteille vastustuskykyisten bakteeri-infektioiden hoitoon. Vaborbaktaamin ja meropeneemin yhdistelmä kuuluu WHO:n laatimaan tärkeimpien lääkeaineiden luetteloon.[2]
Ominaisuudet ja käyttö
[muokkaa | muokkaa wikitekstiä]Vaborbaktaami on rakenteeltaan heterosyklinen boronihappo. Se sitoutuu gramnegatiivisten bakteerien beetalaktamaasientsyymien aktiiviseen kohtaan muodostaen additiotuotteen. Tällöin entsyymi inaktivoituu. Vaborbaktaamia käytetään yhdessä meropeneemin kanssa, koska meropeneemi on varsinainen antibiootti ja vaborbaktaami estää bakteereja hydrolysoimasta meropeneemiä ja tämä parantaa antibiootin tehoa. Vaborbaktaamin on todettu olevan tehokas myös Klebsiella pneumoniae-bakteerin betalaktamaaseja vastaan, johon monet muut betalaktamaasien estäjät eivät tehoa. Vaborbaktaamin ja meropeneemin yhdistelmä annostellaan suonensisäisesti ja sitä käytetään keuhkokuumeen ja vaikeiden virtsatietulehdusten ja vatsan tulehdusten hoitoon. Yhdysvalloissa yhdistelmä hyväksyttiin vuonna 2017 ja Euroopan unionin alueella vuonna 2018.[1][3][4][5][6]
Haittavaikutukset
[muokkaa | muokkaa wikitekstiä]Vaborbaktaamin ja meropeneemin yhdistelmän aiheuttamia haittavaikutuksia voivat olla pääkipu, huonovointisuus ja ripuli.[1][6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d David C. Griffith, Jeffery S. Loutit, Elizabeth E. Morgan, Stephanie Durso & Michael N. Dudley: Phase 1 Study of the Safety, Tolerability, and Pharmacokinetics of the β-Lactamase Inhibitor Vaborbactam (RPX7009) in Healthy Adult Subjects. Antimicrobial Agents and Chemotherapy, 2016, 60. vsk, nro 10, s. 6326–6332. Artikkelin verkkoversio. Viitattu 13.11.2019. (englanniksi)
- ↑ WHO Model List of Essential Medicines 2019. WHO. Viitattu 11.11.2019. (englanniksi)
- ↑ Scott J. Hecker, K. Raja Reddy, Maxim Totrov, Gavin C. Hirst, Olga Lomovskaya, David C. Griffith, Paula King, Ruslan Tsivkovski, Dongxu Sun, Mojgan Sabet, Ziad Tarazi, Matthew C. Clifton, Kateri Atkins, Amy Raymond, Kristy T. Potts, Jan Abendroth, Serge H. Boyer, Jeffrey S. Loutit, Elizabeth E. Morgan, Stephanie Durso & Michael N. Dudley: Discovery of a Cyclic Boronic Acid β-Lactamase Inhibitor (RPX7009) with Utility vs Class A Serine Carbapenemases. Journal of Medicinal Chemistry, 2015, 58. vsk, nro 9, s. 3682–3692. Artikkelin verkkoversio. Viitattu 13.11.2019. (englanniksi)
- ↑ Olga Lomovskaya, Dongxu Sun, Debora Rubio-Aparicio, Kirk Nelson, Ruslan Tsivkovski, David C. Griffith & Michael N. Dudley: Vaborbactam: Spectrum of Beta-Lactamase Inhibition and Impact of Resistance Mechanisms on Activity in Enterobacteriaceae. Antimicrobial Agents and Chemotherapy, 2017, 61. vsk, nro 11, s. e01443-17. Artikkelin verkkoversio. Viitattu 13.11.2019. (englanniksi)
- ↑ FDA approves new antibacterial drug 29.8.2017. FDA. Viitattu 13.11.2019. (englanniksi)
- ↑ a b Vabomere (meropeneemi/vaborbaktaami) 2018. Euroopan lääkevirasto. Viitattu 13.11.2019.
