Rasvahappoamidihydrolaasi
| Rasvahappoamidihydrolaasi | |
| |
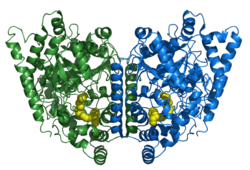
| Rotan FAAH:n homodimeeri (PDBID: 1MT5). Aktiivisissa kohdissa on arakidonihapon inhibiittoreina toimivat johdannaiset (keltaisella). | |
| Tunnisteet | |
| EC-numero | 3.5.1.99 |
| Tietokannat | |
| KEGGt | KEGG |
| Entrez | 2166 |
| OMIM | 602935 |
| UniProt | O00519 |
Rasvahappoamidihydrolaasi eli FAAH on nisäkkäiden lipidikalvoista löytyvä entsyymi (amidaasi), joka hajottaa hydrolyysin kautta joitakin rasvahappojen amideita. Se hajottaa eritoten anandamidia arakidonihapoksi ja 2-aminoetanoliksi sekä vähäisessä määrin 2-arakidonyyliglyserolia arakidonihapoksi ja glyseroliksi. 2-AG:tä hajottaa ensijaisesti monoasyyliglyserolilipaasi eli MAGL. Anandamidi ja 2-AG ovat tärkeimmät nisäkkäiden endokannabinoidit. FAAH hydrolysoi keskeisesti myös endokannabinoideihin kuulumattomia N-palmitoyylietanoliamiinia (PEA) ja oleyylietanoliamiinia (OEA), jotka vähentävät tulehdusreaktioita ja kiputuntemuksia.[1]
Ihmisillä on myös rasvahappoamidihydrolaasi 2 (FAAH2), joka on eri entsyymi kuin FAAH. FAAH2 on kuitenkin toiminnoiltaan samankaltainen kuin FAAH.[2]
Geeni, rakenne ja sijainti
[muokkaa | muokkaa wikitekstiä]Ihmisillä FAAH:n geeni on FAAH ja se on kromosomissa 1 kohdassa 1p33.[3] Ihmisten FAAH koostuu yhdestä 579:n aminohapon peptidiketjusta, jonka massa on noin 60 kDa. Solukalvoissa se on homodimeeri.[4]
FAAH:ta on ihmisillä paljon eritoten keskushermostossa, joissa se on lähinnä soomassa ja tuojahaarakkeissa solujen sisäisissä kalvoissa, kuten sileässä solulimakalvostossa ja mitokondrioiden ulkokalvoissa. Sitä on myös muualla kehossa, mutta alueellisesti keskushermostoa rajoittuneemmin.[1]
Lääkinnällinen merkitys
[muokkaa | muokkaa wikitekstiä]FAAH:n toimintaa estäviä aineita voitaisiin käyttää kipu- tai masennuslääkkeinä, sillä esto lisää kannabinoidireseptoreihin aktivoivasti sitoutuvien endokannabinoidien pitoisuuksia ihmiskehossa. Estäjät voisivat siis toimia vaihtoehtona tetrahydrokannabinolin kaltaisille ulkoisille kannabinoidireseptorien agonistien annostelulle.[1]
FAAH-estäjiä on kehitetty monia, mutta mitään niistä ei ole toistaiseksi hyväksytty lääkemarkkinoille. Useat FAAH-estäjät ovat osoittautuneet vaarattomiksi, mutta joidenkin estäjien testaus on lopetettu esimerkiksi siksi, että niiden on havaittu olevan lääkinnällisesti tehottomia. Kuitenkin vuonna 2016 Bial-lääkeyhtiön kehittämän "BIA 10-2474"-nimisen kokeellisen FAAH-estäjän antaminen Ranskassa 90:lle koehenkilölle johti yhden koehenkilön kuolemaan aivoverenvuodon takia ja aiheutti neljälle pysyvän aivovaurion.[5]
Puutos
[muokkaa | muokkaa wikitekstiä]Vuonna 2019 tuolloin 66-vuotiaalta skotlantilaiselta naiselta löydettiin toimimaton FAAH:n geeni yhdestä alleelista (eli heterotsygoottinen puuttuvan toiminnan mutaatio). Alleelista oli poistunut pieni osa eli kyse oli mikrodeleetiosta. Mutaation seurauksena muodostuneelle toimimattomalle geenille eli pseudogeenille annettiin nimi FAAH-OUT. Mutaation takia nainen ei ollut tuntenut elämänsä aikana koskaan kipua (katso kongenitaalinen analgesia), pelkoa tai ahdistusta, mutta poti huonomuistisuutta. Mutaation takia naisella oli veressään noin 70% normaalia enemmän anandamidia sekä noin kolme kertaa enemmän oleyylietanoliamiinia ja palmitoyylietanoliamidia.[6]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c K Ahn, DS Johnson, BF Cravatt: Fatty acid amide hydrolase as a potential therapeutic target for the treatment of pain and CNS disorders. Expert opinion on drug discovery, 2009, 4. vsk, nro 7, s. 763–784. PubMed:20544003 doi:10.1517/17460440903018857 ISSN 1746-0441 Artikkelin verkkoversio.
- ↑ S Sirrs et al: Defects in fatty acid amide hydrolase 2 in a male with neurologic and psychiatric symptoms. Orphanet Journal of Rare Diseases, 2015, 10. vsk. PubMed:25885783 doi:10.1186/s13023-015-0248-3 ISSN 1750-1172 Artikkelin verkkoversio.
- ↑ JA López-Moreno, V Echeverry-Alzate, K Bühler: The genetic basis of the endocannabinoid system and drug addiction in humans. Journal of Psychopharmacology, 2012, 26. vsk, nro 1, s. 133–143. PubMed:21937688 doi:10.1177/0269881111416689 ISSN 1461-7285 Artikkelin verkkoversio.
- ↑ M Lorca et al: Three-dimensional quantitative structure-activity relationships (3D-QSAR) on a series of piperazine-carboxamides fatty acid amide hydrolase (FAAH) inhibitors as a useful tool for the design of new cannabinoid ligands. International Journal of Molecular Sciences, 2019, 20. vsk, nro 10, s. 2510. PubMed:31117309 doi:10.3390/ijms20102510 Artikkelin verkkoversio.
- ↑ R Kaur, P Sidhu, S Singh: What failed BIA 10–2474 phase I clinical trial? Global speculations and recommendations for future Phase I trials. Journal of Pharmacology & Pharmacotherapeutics, 2016, 7. vsk, nro 3, s. 120–126. PubMed:27651707 doi:10.4103/0976-500X.189661 ISSN 0976-500X Artikkelin verkkoversio.
- ↑ AM Habib et al: Microdeletion in a FAAH pseudogene identified in a patient with high anandamide concentrations and pain insensitivity. British Journal of Anaesthesia, 2019, 123. vsk, nro 2, s. e249–e253. PubMed:30929760 doi:10.1016/j.bja.2019.02.019 ISSN 0007-0912 Artikkelin verkkoversio.