Lyijykloridi
| Lyijykloridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | PbCl2 |
| Moolimassa | 278,11 |
| Ulkomuoto | Valkoinen kiteinen aine[1] |
| Sulamispiste | 501 °C[1] |
| Kiehumispiste | 950 °C[1] |
| Tiheys | 5,85 g/cm3[1] |
| Liukoisuus veteen |
9,9 g/l (20 °C) 33,4 g/l (100 °C)[1] |
Lyijykloridi eli lyijydikloridi (PbCl2) on lyijy- ja kloridi-ionien muodostama epäorgaaninen ioniyhdiste. Yhdistettä käytetään muun muassa väriaineena ja lasinvalmistuksessa. Luonnossa lyijykloridia esiintyy kotunniittimineraalissa.
Ominaisuudet
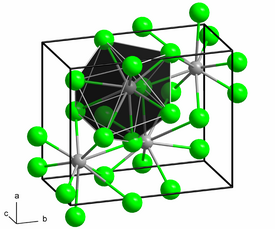
[muokkaa | muokkaa wikitekstiä]Lyijykloridi on huoneenlämpötilassa valkoisia rombisia kiteitä. Sen kiderakenteessa jokainen lyijyionin ympärillä on 9 kloridi-ionia ja jokaisen kloridin-ionin ympärillä on 4 tai 5 lyijyionia. Lyijykloridi liukenee vain hyvin vähän veteen, mutta liukenee paremmin vetykloridi- ja ammoniakkiliuoksiin, mikä johtuu kompleksi-ionien muodostumisesta.[1][2][3] Esimerkiksi kloridi-ionien kanssa yhdiste muodostaa trikloroplumbaatti- ([PbCl3]-] ja tetrakloroplumbaatti-ioneja ([PbCl2]2-).[4] Kloorin kanssa yhdiste reagoi muodostaen lyijy(IV)kloridia[1][4].
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]Yhdistettä muodostuu lyijyn ja kloorin välisessä reaktiossa, mutta pääasiassa sitä valmistetaan muilla tavoin. Lyijykloridia valmistetaan neutraloimalla vetykloridia lyijymonoksidilla tai lyijykarbonaatilla. Toinen tapa on lyijyasetaatin ja vetykloridin välinen reaktio. Yhdiste liukenee veteen vain vähän, joten se kiteytyy liuoksesta ja voidaan suodattaa.[1][2][3]
- 2 HCl + PbO → PbCl2 + H2O
Lyijykloridia käytetään yhdessä lyijyhydroksidin kanssa valkoisena väriaineena. Muita käyttökohteita ovat muiden lyijy-yhdisteiden, erityisesti organolyijy-yhdisteiden, valmistus, kokatalyyttinä akryylinitriilin ja alkeenien polymeroinnissa, eräiden lasilaatujen valmistuksessa, palonestoaineena polymeereissä, katodina lyijykloridi-magnesiumakuissa, analyyttisessä kemiassa alkaloidien toteamiseen ja teräksessä korroosiota estävänä aineena.[1][2][3]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h i E. M. Karamäki: Epäorgaaniset kemikaalit, s. 247. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3
- ↑ a b c Dayal T. Meshri: Lead Compounds, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2001 Viitattu 5.4.2014
- ↑ a b c Dodd S. Carr: Lead Compounds Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2002. Viitattu 5.4.2014
- ↑ a b Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 915. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa (viitattu 5.4.2014). (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- PubChem: Lead(2+) dichloride (englanniksi)
- Toxin and Toxin Target Database (T3DB): Lead chloride (englanniksi)
- ChemBlink: Lead dichloride (englanniksi)
- Webmineral: Cotunnite Mineral Data (englanniksi)