Etomidaatti

| |
| |
Etomidaatti
| |
| Systemaattinen (IUPAC) nimi | |
| Etyyli-3-[(1R)-1-fenyylietyyli]imidatsoli-4-karboksylaatti | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | N01 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C14H16N2O2 |
| Moolimassa | 244,288 |
| SMILES | Etsi tietokannasta: , |
| Fysikaaliset tiedot | |
| Sulamispiste | 67 °C [1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | ? |
| Proteiinisitoutuminen | 76,5 %[2] |
| Metabolia | Hepaattinen |
| Puoliintumisaika | 75 min[3] |
| Ekskreetio | ? |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | Intravenoosi |
Etomidaatti (C14H16N2O2) on imidatsolijohdannaisiin kuuluva orgaaninen yhdiste. Yhdistettä voidaan käyttää lääketieteessä ja eläinlääketieteessä anestesia-aineena.
Ominaisuudet ja käyttö
[muokkaa | muokkaa wikitekstiä]Etomidaatti on huoneenlämpötilassa kiteistä ainetta. Yhdiste on veteen liukenematonta, mutta liukenee moniin orgaanisiin liuottimiin, esimerkiksi etanoliin, propyleeniglykoliin, asetoniin ja kloroformiin. Etomidaatti on optisesti aktiivista, ja sen R-enantiomeeri on huomattavasti tehokkaampi sedaation aikaansaamisessa kuin S-enantiomeeri. (R)-Etomidaatin ominaiskiertokyky etanoliliuoksessa on +66.[1][4]
Etomidaatti aikaansaa sedaation ja anestesian sitoutumalla GABA-reseptoreihin ja estämällä niiden toimintaa. Lääkeaineen aiheuttama sedaatio alkaa nopeasti ja on suhteellisen lyhytaikainen ja sitä käytetään lähinnä anestesian aloittamiseen. Etomidaatin etuna moneen muuhun anestesia-aineeseen on, että se ei vaikuta verenkiertoa häiritsevästi. Tämä on tärkeää erityisesti nukutettaessa sokissa olevia tai traumapotilaita, joilla verenkierto on muutenkin epävakaa. Etomidaatti annostellaan liuoksena suoneen.[4][2][5][6][7]
Haittavaikutukset
[muokkaa | muokkaa wikitekstiä]Tärkein etomidaatin haittavaikutus on lisämunuaisen kuorikerroksessa tapahtuvan kortikosteroidihormonien biosynteesin inhibitio. Inhiboituminen johtuu hydroksyloivien entsyymien toiminnan estymisestä. Tämä voi ilmetä alhaisena verenpaineena, alhaisena natriumpitoisuutena ja kohonneena kaliumpitoisuutena. Tämä voi olla vaarallista erityisesti verenmyrkytyksestä kärsivillä potilailla, joilla lisämunuaisten toiminnan lamaantumisen riski on muutenkin korkea.[6]
Valmistus
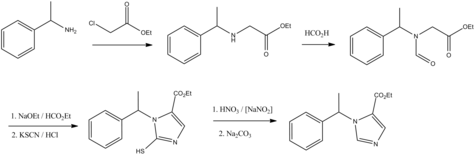
[muokkaa | muokkaa wikitekstiä]Etomidaatin synteesin lähtöaine on metyylibentsyyliamiini, joka reagoi ensimmäisessä vaiheessa etyyliklooriasetaatin kanssa muodostaen esterin. Tämän jälkeen yhdisteen aminoryhmä reagoi muurahaishapon kanssa ja tuotteena muodostuu aminoaldehydi. Tämä aminoaldehydi reagoi metyyliformiaatin ja kaliumtiosyanaatin kanssa tioimidatsolijohdannaiseksi. Viimeisessä vaiheessa tämä välituote hapetetaan natriumnitriitin ja typpihapon avulla etomidaatiksi.[4]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b Susan Budavari (päätoim.): Merck Index, s. 658. (12th Edition) Merck & Co., 1996. ISBN 0911910-12-3 (englanniksi)
- ↑ a b Jürgen Schüttler,Helmut Schwilden: Modern Anesthetics, s. 267-270. Springer, 2008. ISBN 978-3-540-72813-9 Kirja Googlen teoshaussa (viitattu 2.8.2017). (englanniksi)
- ↑ Etomidate DrugBank. Viitattu 2.8.2017. (englanniksi)
- ↑ a b c Hartmund Wollweber: Anesthetics, General, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 2.8.2017
- ↑ George R. Lenz, Hollis G. Schoepke & Theodore C. Spaulding: Anesthetics, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000. Viitattu 2.8.2017
- ↑ a b Esa Hammarén: Joutaako etomidaatti romukoppaan. Finnanest, 2006, 39. vsk, nro 1, s. 33-35. Artikkelin verkkoversio. Viitattu 1.11.2023.
- ↑ Jim E. Riviere,Mark G. Papich: Veterinary Pharmacology and Therapeutics, s. 284. John Wiley and Sons, 2013. ISBN 978-1-118-68590-7 Kirja Googlen teoshaussa (viitattu 2.8.2017). (englanniksi)