Enolit
Enoli tai alkenoli on alkeeni, jossa hydroksyyliryhmä on sitoutunut hiiliatomiin, jolla on kaksoissidos. Nimitys enoli on yhdistetty kaksoissidoksen en- ja alkoholin -oli -tunnisteista. Enolit ja karbonyyliyhdisteet, kuten ketonit ja aldehydit, ovat isomeerejä. Puhtainakin aineina ne muuttuvat spontaanisti toisikseen. Tätä kutsutaan keto-enolitautomeriaksi. Usein toinen tautomeeri on paljon suositumpi; yleensä se on ketoni tai aldehydi, mutta jos kaksoissidos on konjugoitunut, myös enolitautomeeri voi olla suositumpi.

Oikeanpuolinen enolimuoto ei ole stabiili, vaan se muuttuu vasemmanpuoleiseksi ketomuodoksi. Happi on elektronegatiivisempi kuin hiili, ja se muodostaa voimakkaampia kemiallisia sidoksia. Näin ollen hiili—happi-kaksoissidos on yli kaksi kertaa voimakkaampi kuin yksinkertainen sidos, mutta hiili—hiili-kaksoissidos on heikompi kuin kaksi yksinkertaista sidosta.
Konjugoituneissa yhdisteissä, kuten 1,3-dikarbonyyli- ja 1,3,5-trikarbonyyliyhdisteissä, enolimuoto on yleisempi, sillä stabiilisuutta lisäävää resonanssia ja molekyylin sisäisiä vetysidoksia muodostuu vain enoli-, eikä ketomuodoissa.

Enolaatti-ioni
[muokkaa | muokkaa wikitekstiä]Kun enolin hydroksyyliryhmä (–OH) luovuttaa vetyionin (H+) eli protonin, muodostuu negatiivinen enolaatti-ioni:

Välituotteena, jota on vaikea havaita, enolaattia voi syntyä sekä happo-, että emäskatalyysillä. Tavalliset vesiliuoksessa stabiilit emäkset eivät ole riittävän vahvoja muuttamaan erikseen stabiloimattomia karbonyyliyhdisteitä merkittävissä määrin enolaateiksi. Tarvitaan superemäs ja täysin vedettömät olosuhteet, jotta saadaan muutettua karbonyyliyhdiste kokonaan enolaatiksi.
On olemassa stabiileja enolaatteja, joissa enolaattia stabiloi resonanssi. Fenoleissa kaksoissidos on aromaattisessa renkaassa. Muita syitä ovat konjugaatio ja keto-enolitautomeria, josta johtuu esimerkiksi askorbiinihapon happamuus.
Emäksenä voidaan käyttää esimerkiksi alkoksidia. Enolaattikemian keskeinen ongelma on se, ettei enolisaatio ole selektiivistä: kun on kaksi mahdollista enolaattia, molempia syntyy. Kylmässä (esim. kuivajää-asetonihaude) ja voimakkailla emäksillä saadaan kineettisesti helpoiten irtoava enolaatti. Lämpimässä ja heikoimmilla emäksillä enoli pääsee palautumaan karbonyyliyhdisteeseen takaisin, kunnes päästään termodynaamiseen tasapainoon. Toinen haaste on se, että jos emäs on liian heikko, karbonyyliyhdistettä jää liuokseen, ja se reagoi enolaatin kanssa. Tämän välttämiseksi on käytettävä superemäksiä.
Enolaattikemialla on osuutensa suuressa osassa monimutkaisten lääkemolekyylien synteesissä.
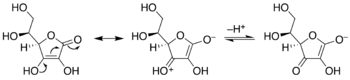
Enediolit
[muokkaa | muokkaa wikitekstiä]Jos enolaatti on konjugoitunut karbonyylin tai muun elektroneja puoleensavetävän ryhmän kanssa, se toimii happona samalla tavalla kuin karboksyylihappo. Kuten karboksyylihapossa, konjugaattiemäksen elektroneja luovuttavan oksianionin ja elektroneja puoleensavetävän karbonyyliryhmän elektronit ovat delokalisoituneet; ainoana erona on välissä oleva enolin π-sidos. Askorbiinihappo on tästä tyypillinen esimerkki.