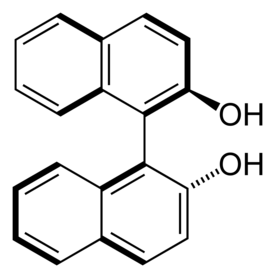
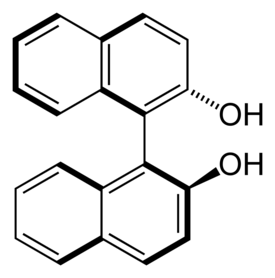
1,1′-bi-2-naftoli
| 1,1'-Bi-2-naftoli | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| IUPAC-nimi | 1-(2-hydroksinaftalen-1-yyli)naftalen-2-oli |
| CAS-numero | |
| PubChem CID | |
| SMILES | C1=CC=C2C(=C1)C=CC(=C2C3=C(C=CC4=CC=CC=C43)O)O[1] |
| Ominaisuudet | |
| Molekyylikaava | C20H14O2 |
| Moolimassa | 286,312 g/mol |
| Sulamispiste | 208–210 °C[2] |
| Liukoisuus veteen | Liukenee tolueeniin, dikloorimetaaniin ja etyylinitraattiin[2] |
1,1'-Bi-2-naftoli eli BINOL (C20H14O2) orgaaninen yhdiste ja 2-naftolin johdannainen. Yhdistettä käytetään orgaanisen kemian synteeseissä kiraalisena katalyyttinä tai apuaineena.
Ominaisuudet ja valmistus
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa 1,1'-Bi-2-naftoli on kiinteää valkoista ainetta. Se on optisesti aktiivinen yhdiste ja esiintyy R- ja S-isomeereinä, vaikka sen rakenne ei sisällä kiraliakeskusta. Sen sijaan sillä on kiralia-akseli ja yhdisteen kiertyminen naftaleenirunkoa yhdistävän yksinkertaisen sidoksen ympäri on rajoitettua. BINOLin hydroksyyliryhmien välisten steeristen vuorovaikutuksten vuoksi se ei ole täysin planaarinen muiden aromaattisten yhdisteiden tavoin. BINOL ei rasemisoidu korkeissakaan lämpötiloissa, minkä vuoksi se ja sen johdanniaset ovat suosittuja apuaineita epäsymmetrisessä synteesissä.[3][4]
Raseemista 1,1'-bi-2-naftolia voidaan valmistaa 2-naftolin oksidatiivisella kytkennällä käyttämällä katalyyttinä siirtämämetallisuoloja esimerkiksi Fe(III)-yhdisteitä. Reaktiossa 2-naftolista muodostuu aryylioksiradikaali, joka dimerisoituu tuotteeksi. Seoksesta voidaan enantiomeerit erottaa resoluutiolla kinkoniinin avulla. S-BINOLia voidaan valmistaa myös puhtaana enantiomeerina. Reaktiossa katalyyttinä toimii Cu(II)-yhdiste yhdessä kiraalisen amiinin kanssa. Useimmiten käytetään (+)-amfetamiinia, joka antaa parhaimman saannon ja enantioylimäärän. R-BINOLia ei voi valmistaa näin, koska se näissä olosuhteissa isomerisoituu hitaasti S-BINOLiksi.[3][2][5]

Käyttö
[muokkaa | muokkaa wikitekstiä]1,1'-Bi-2-naftolia ja sen johdannaisia käytetään kiraalisina apuaineina. Se muodostaa komplekseja muun muassa alumiinin, titaanin, harvinaisten maametallien ja maa-alkalimetallien kanssa. Näitä käytetään asymmetrisinä apuaineina muun muassa eräissä hapetuksissa ja pelkistyksissä, epoksidoinneissa, Diels–Alder-reaktiossa, eenireaktioissa, aldolikondensaatiossa ja Michael-additiossa. Siitä valmistetaan myös asymmetrisissä pelkistyksissä käytettävää BINAP-yhdistettä käsittelemällä sitä fosfoniumsuolalla. BINOL:ia ja eräitä sen johdannaisia on tutkittu myös käytettäväksi organokatalyytteinä ilman koordinoitunutta metalli-ionia.[2][4][5][6][7]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ 1,1'-bi-2-naphthol – Substance summary NCBI. Viitattu 7. helmikuuta 2012.
- ↑ a b c d Koichi Mikami, Yukihiro Motoyama, Jan Michel Brunel: (R)-1,1′-Bi-2,2′-naphthol, e-EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, New York, 2001 Teoksen verkkoversio Viitattu 07.02.2012
- ↑ a b Dana W. Mayo,Ronald M. Pike,David C. Forbes: Microscale Organic Laboratory, s. 664. Wiley-VCH, 2010. ISBN 978-3-527-30603-9 Kirja Googlen teoshaussa (viitattu 07.02.2012). (englanniksi)
- ↑ a b Qi-Lin Zhou: Privileged Chiral Ligands and Catalysts, s. 295-324. John Wiley & Sons, 2011. ISBN 978-3527327041 Kirja Googlen teoshaussa (viitattu 07.02.2012). (englanniksi)
- ↑ a b Leo A. Paquette: Handbook of reagents for organic synthesis, s. 86. John Wiley and Sons, 1999. ISBN 978-0-470-85625-3 Kirja Googlen teoshaussa (viitattu 07.02.2012). (englanniksi)
- ↑ Leo A. Paquette: Handbook of reagents for organic synthesis, s. 86. John Wiley and Sons, 1999. ISBN 978-0-470-85625-3 Kirja Googlen teoshaussa (viitattu 07.02.2012). (englanniksi)
- ↑ Reinhard Brückner: Advanced organic chemistry: reaction mechanisms, s. 215. Academic Press, 2002. ISBN 978-0-12-138110-3 Kirja Googlen teoshaussa (viitattu 07.02.2012). (englanniksi)