Konformaatio

Kemiassa konformaatio tarkoittaa kaikkia molekyylin kolmiulotteisia muotoja, joita muodostuu molekyylin yksöissidosten kiertyessä ja joidenkin sidosten välisten sidoskulmien muuntuessa ilman että kummassakaan tapauksessa kemiallisia sidoksia rikkoutuu. Myös trigonaalisten pyramidien inversiot (kuten amiinien) ja niiden kaltaiset muutokset voidaan lukea konformaatioiksi. Sidosten rikkoutuessa ja muodostuessa jälleen samojen atomien välille, olisi konformaatiomuutoksen sijaan kyseessä konfiguraation muuntuminen toiseksi konfiguraatioksi.[1]
Konformaatio- ja konfiguraatiomuutosten kautta molekyylit voivat muuntua eri stereoisomeereiksi. Konformeerit ovat stereoisomeerejä. Konformeerejä ovat molekyylit, jotka konformaatiomuutoksen kautta saavuttavat paikallisen potentiaalienergiaminimin. Konformeerin energia kasvaa jos sen konformaatio muuttuu mittaamattoman pienen määrän eli infinitesimaalisesti. Tällöin molekyyli ei enää ole konformeeri.[1] Molekyylillä voi olla monia konformeerejä, eivätkä ne kaikki ole kaikkein pienienergisimpiä mahdollisista konformeereistä. Pienienergisimmän konformeerin voidaan sanoa olevan globaalissa energiaminimissä paikallisen minimin sijaan.[2]

Konformeria jaetaan alaluokkiin, kuten rotameereihin, joissa paikallinen energiaminimi saavutetaan vain yhden yksöissidoksen vapaalla kiertymisellä. Jos sidoskiertyminen ei ole vapaata vaikkapa steeristen esteiden takia, ovat nämä muuten samanlaiset molekyylit toistensa atropisomeerejä. Kiertyminen ei ole vapaata, jos siihen vaadittava energia on niin suuri (IUPAC ei ole määrittänyt kuinka suuri), ettei sitä käytännössä havaita.[1]
Konformeriatyypit
[muokkaa | muokkaa wikitekstiä]Konformeriamuotoja ovat muun muassa
- rotameria – yhden yksöissidoksen pienen energian vaatiman kiertymisen aiheuttama konformeria. Esimerkki: butaani.[1]
- atropisomeria – kuten edellä, mutta kiertyminen vaatii esimerkiksi steeristen esteiden takia niin suuren energian, että toistensa atropisomeerit voidaan erotella toisistaan.[1] Esimerkki: BINAP.[4]
- rengaskonformaatiot – rengasrakenteiden molekyylien kuten syklohekseenin tuoli-kierrevene -konformeria.[2]
- laskostuminen – sanaa käytetään tavasta, jolla proteiinit ovat muodostaneet sekundääri- ja tertiäärirakenteensa.[5]
- akamptisomeria – 2018 löydetty tyyppi.[6][7] Tämä ei kuitenkaan ole IUPAC:n tunnistama termi.
Rotameria
[muokkaa | muokkaa wikitekstiä]Rotameeri muuntuu toiseksi rotameeriksi vain yhden yksöissidoksen kiertymisen kautta. Kierros vaatii vain pienen energian.[1] Esimerkki rotameriasta on butaani (CH3-CH2-CH2-CH3), jonka edeltävän kaavan tummennettujen hiilten välisen yksöissidoksen kiertyessä muodostuu kaksi eri rotameeriä (kuva alla).

Rotamerian analyysi
[muokkaa | muokkaa wikitekstiä]Sidosten kiertymisen suotuisuutta selitetään kahdella tavalla:
- steerinen hyljintä – ryhmien ollessa kohdakkain, voivat niiden elektronein täytetyt molekyyliorbitaalit hylkiä toisiaan erityisesti jos ryhmät ovat suuria.[2]
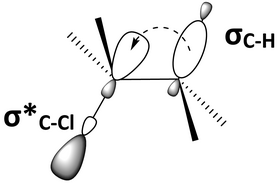
- vahventava hyperkonjugaatio – ryhmien ollessa lomittain, voi niissä oleva elektroniparilla täytetty sitova σ-orbitaali ja elektroneista tyhjä anti-sitova σ*-orbitaali mennä päällekkäin ja yhdistyä eli hyperkonjugoitua. Muodostuu yksi alkuperäistä hajottavaa orbitaalia korkeaenergisempi hajottava orbitaali ja sitovaa pienienergisempi sitova orbitaali. Sidoselektronipari siirtyy pienienergiselle orbitaalille, madaltaen konformaation potentiaalienergiaa lisäten siten tämän muotoisen konformaation suotuisuutta.[8]
Hyperkonjugaation sijaan saatetaan myös sanoa kohdakkaisella konformaatiolla olevan kierto- eli torsionaalista jännitytystä (engl. torsional strain), erityisesti käsiteltäessä pieniä vedyn kaltaisia atomeja. Tällä viitataan ilmiöön, jossa kohdakkaisuus on epäsuotuisaa, muttei välttämättä kerrota, mistä epäsuotuisuus johtuu. Etaanilla lomittaisen konformaation suotuisuus johtuu lähinnä siitä, että energiaa madaltava hyperkonjugaatio on tässä muodossa mahdollinen. Etaanilla tämä selittää siis kohdakkaisen konformaation epäsuotuisuuden eli "torsionaalisen jännityksen" koska suotuisa hyperkonjugaatio lakkaa vaikuttamasta kohdakkaisessa muodossa.[3]
Myös butaanissa hyperkonjugaatiota voidaan pitää merkittävimpänä tekijänä. Butaanin lomittaisessa konformaatiossa, joka on merkitty tämän osion alkukuvassa A:ksi, hyperkonjugaatio madaltaa konformaation energiaa hylkivien vaikutusten ollessa vähäisiä. B:ssä hyperkonjugaatio lisää suotuisuutta, mutta metyylit ovat lähellä toisiaan aiheuttaen vähäistä steeristä hyljintää. C:ssä hyperkonjugaatio ei pääse vaikuttamaan ja lähinnä tämä lisää C:n energiaa. D:ssä hyperkonjugaatio ei vaikuta ja metyylien toisilleen aiheuttama steerinen este lisää energiaa tästä vielä hieman.[3]

Myös konjugaatio vaikuttaa. Konjugoimattomassa etaanissa kierähdys energiavallin yli vaatii 12 kcal/mol.[2] Konjugoituneen sigma- eli s-cis-butadieenin yksöissidoksen kierto s-trans-muotoon vallin yli vaatii noin 30 kJ/mol,[9] sillä konjugaatio antaa näennäiselle yksöissidokselle hieman kaksoissidosluonnetta. Dimetyyliformamidin tätä konjugoituneemman amidisidoksen 180° kierto vaatii jo 85 kJ/mol. Vertailun vuoksi 2-buteenin kierto vaatii energiaa jo noin 260 kJ/mol koska tässä on varsinainen kaksoissidos, jonka kierto vaatii piisidoksen väliaikaista rikkomista.[2] 2-buteenissa kyse ei enää kuitenkaan ole konformeriasta, koska sidoksia rikkoutuu.[1]
Atropisomeria
[muokkaa | muokkaa wikitekstiä]
Atropisomeereissä jonkin yksöissidoksen kiertyminen on osin estynyttä, koska sidoksen täydellinen kiertyminen vaatii niin paljon energiaa ettei kiertymistä havaita käytännössä. Toistensa atropismeerit eivät spontaanisti muunnu toisikseen ja ne voidaan teoriassa erottaa toisistaan erillisinä aineina. Atropisomeerit voivat ilmentää aksiaalista kiraalisuutta. Esimerkkejä atropisomeriasta ovat jotkin substituoidut orto-bifeenylit (kuva), 1,1,2,2-tetra-tert-butyylietaani,[1] BINAP, BINOL ja telentsipiini.[4]
Rengaskonformeria
[muokkaa | muokkaa wikitekstiä]Rengaskonformeriaa ilmentävät molekyylit, joissa on rengasrakenteita. Esimerkki tästä on sykloheksaani, jossa energiaminimin muodostavat tuoliksi- ja kierreveneeksi kutsutut konformaatiot.[2] Ne ovat siten toistensa konformeerejä.[1]

Rengasjännitys
[muokkaa | muokkaa wikitekstiä]
Orgaanisissa rengasrakenteissa näiden pyrkimys päästä eri konformaatioihin esimerkiksi hiilirungoltaan täysin tasomaisten rakenteiden sijaan selittyy ensisijaisesti sillä, että renkaiden hiilet pyrkivät muodostamaan ympärilleen sidokset tetraedrimuotoisesti neljään eri atomiin. Hiilissä sidosten orbitaalit ovat sp3-hybridisoituneet ihannetilanteessa noin 109.5° (tarkempi arvo noin 109.4712°) kulmiin suhteessa muihin sidoksiin. Kulmat muodostavat tetraedrin. Täysin tasomaisissa molekyyleissä kulmat eivät ole 109.5°, joten niillä on konformaation potentiaalienergiaa lisäävää rengasjännitystä. Muissa kuin tasomaisissa komformaatioissa kulmat ovat lähempänä 109.5° ihannekulmaa.[2]
Esimerkiksi tasomaisen sykloheksaanin hiilten välisten sidosten kulmat olisivat 120° (katso säännöllinen kuusikulmio) aiheuttaen rengasjännitystä. Tämä on niin suurta ettei tasomuotoa ole olemassa. Tuolisykloheksaanin sidoskulmat ovat teoriassa ihanteelliset (109.5°), eikä rengasjännitystä siten ole. Tuolin sanotaan usein olevan rengasjännityksetön. Tämä ei ole totta lähinnä siksi, koska aksiaalisiin (katso Aksiaalisuus ja ekvatoriaalisuus) vetyihin vaikuttavat hylkivästi toiset saman puolen aksiaaliset vedyt. Siksi rengas pyrkii vähentämään tätä vuorovaikutusta litistymällä hieman, jolloin aksiaaliset vedyt taipuvat ekvatoriaalisemmiksi. Tuolin hiilten kulmat siksi ovat rengasjännityksen ja steerisen vaikutuksen välisenä kompromissina oikeasti noin 111.5°. Tähän hiili-hiili kulmaan vaikuttavat hieman myös hiilen sitomat vedyt. Kulmat ovat myös erilaiset hiilten ja vetyjen, sekä vetyjen ja vetyjen välillä, koska nämä eivät ole identtisiä ja vievät toisiltaan steerisesti eri verran tilaa.[10]
Renkaiden hyperkonjugaatio ja muut vaikutukset
[muokkaa | muokkaa wikitekstiä]
Hiilten väliset kulmat ovat lähes 109.5° myös venesykloheksaanissa. Siksi veneen voisi olettaa olevan energiallisesti suotuisa. Vedyt ovat kuitenkin veneessä kohdakkain, jolloin niiden σ- ja σ*-orbitaalit eivät voi kunnolla hyperkonjugoitua (katso Rotamerian analyysi). Tämä tekee veneestä epäsuotuisan. Lisäksi veneen päiden aksiaaliset vedyt tulevat lähelle toisiaan (kuva) aiheuttaen steerisen esteen, mutta tämä vaikutus on hyperkonjugaation osittaiseen puutteeseen verrattuna pieni. Kierrevenemuodossa vaikutukset ovat samankaltaiset kuin veneessä, mutta kiertynyt rakenne vähentää edeltäviä vaikutuksia; kiertymisen takia erityisesti hyperkonjugaatio pääsee vaikuttamaan potentiaalienergiaa madaltaen.[10]
Hyperkonjugaation merkitys näkyy hyvin syklopentaanissa. Sen tasomuodossa, jota ei oikeasti ole olemassa, hiilten kulmat olisivat 108° (katso säännöllinen viisikulmio) – lähes ihanteelliset. Tasossa vedyt kuitenkin ovat kohdakkain, jolloin rakennetta vakauttavaa hyperkonjugaatiota ei ole. Siksi syklopentaanin kaikkein suotuisin konformeeri on taipunut kirjekuorikonformaatio, jossa hyperkonjugaatio vaikuttaa. Kompromissina kirjekuoressa kaikki rakenteen hiilikulmat kuitenkin pienenevät ja rengasjännitys kasvaa – kirjekuoren kulmat ovat 102–106°.[10]
Renkaiden substituointi
[muokkaa | muokkaa wikitekstiä]Substituoituun hiilivetyrenkaaseen on liittynyt vetyjen tilalle substituentteja eli muita atomeita tai atomiryhmiä. Ryhmä olla vaikka hydroksyyli (katso sykloheksanoli). Monosubstituoidussa renkaassa ryhmiä on yksi, disubstituoidussa kaksi jne.
| Substi -tuentti |
Tasapai -nova -kio, K |
Aksiaalisen ja ekvatoriaali -sen energiaero, kJ/mol |
Ekvatoriaali -muodon yleisyys, % |
|---|---|---|---|
| H | 1 | 0 | 50 |
| OMe | 2.7 | 2.5 | 73 |
| Me | 19 | 7.3 | 95 |
| Et | 20 | 7.5 | 95 |
| i-Pr | 42 | 9.3 | 98 |
| t-Bu | >3000 | >20 | >99.9 |
| Ph | 110 | 11.7 | 99 |
Substituoitu sykloheksaani pyrkii yleensä tuolikonformaatioon. Tästä se pyrkii rengaskäännöksen kautta tuoliksi, jossa mahdollisimman moni substituentti on ekvatoriaalisesti (katso Aksiaalisuus ja ekvatoriaalisuus). Substituentin koko vaikuttaa suotuisuuteen.[10] Esimerkiksi suuren tert-butyyliryhmän (t-Bu, taulukko) ollessa substituenttina, on se yli 3000 kertaa suuremmalla todennäköisyydellä ekvatoriaalisessa asemassa kuin aksiaalisessa. Ekvatoriaalisen konformaation energia on 20 kJ/mol pienempi kuin aksiaalisesti substituoidun. Metoksiryhmä (OMe) taas on pienempi, joten sen ollessa substituenttina, se on vain 2,7 kertaa todennäköisemmin ekvatoriaalisesti.[2]
Sykloheksaani voi olla disubstituoitu siten, että toinen substituentti on tuolissa aksiaalisesti ja toinen ekvatoriaalisesti. Jos nämä ovat identtisiä, ovat molemmat käännöksen tuolimuodot yhtä suotuisia. Jos toinen substituentti onkin suurempi, on se tuolimuoto suotuisampi, jossa isompi substituentti on ekvatoriaalisesti. Suotuisin konformeeri riippuu siis substituenttien koosta ja lukumäärästä edeltäviin sääntöihin pohjautuen.[10]


Aksiaalisen substituoinnin epäsuotuisuus johtuu steerisestä esteestä, jonka muut aksiaaliset ryhmät aiheuttavat aksiaaliselle substituentille.[10] Konformaatioita tarkastellessa tulee kuitenkin muistaa, että jotkin substituentit rajoittavat muiden substituenttien kääntymistä. Esimerkiksi karbonyyli (=O), jollainen on vaikkapa sykloheksanonissa, saa aikaan karbonyylin hiileen ja kahteen sen viereiseen hiileen tasomaisen rakenteen. Tämä johtuu karbonyylihiilen pyrkimyksestä asettua sidosorbitaaleiltaan tasokolmion muotoon sp2 hybridisaation takia.[2]

Sykloheksaanin lisäksi muut renkaat kuten syklobutaani ja syklopentaani voivat läpikäydä omanlaisensa rengaskäännökset. Kaikki rengasrakenteet eivät tähän pysty. Esimerkiksi kaksirenkainen cis-dekaliinin voi läpikäydä rengaskäännöksen, mutta trans-muoto ei, koska toisen renkaan käännös vaatii tämän renkaan jonkin hiilten välisen sidoksen katkeamista.[10]
Rengaskonformaatioiden nimet
[muokkaa | muokkaa wikitekstiä]Rengaskonformaatioita on useita ja näille on omat nimensä. Kruunu, josta on esimerkki alla taulukossa, on eräs muoto, jota esiintyy yli kahdeksan hiilen renkailla, joissa hiiliä on parillinen määrä.[1]
Alla on joitain rengaskonformaatioiden esimerkkejä. Lista ei ole täydellinen, eikä listan renkaiden kaikkia mahdollisia konformaatioita ole esitetty. Osa renkaista on konformeerejä, osa ei ole.
| C lkm. | Kuva | Konformaation nimi, eng. nimi |
Molekyylin nimi |
|---|---|---|---|
| 4 | 
|
Taipunut, puckered | Syklobutaani. |
| 5 | 
|
Kirjekuori, envelope[1] | Syklopentaani. |
| Puolituoli, half-chair | |||
| 6 | 
|
Tuoli, chair[1] | Sykloheksaani. |
| Vene, boat[1] | |||

|
Kierrevene, twist-boat | ||

|
Puolituoli, half-chair[1] | ||
| 7 | Tuoli, chair[11] | Sykloheptaani. | |
| Vene, boat[11] | |||
| 8 | 
|
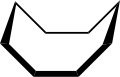
Kruunu, crown[12] | Syklo-oktaani. |
|
Allas, tub[1] | ||

|
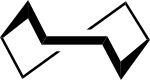
Vene-vene[12] | ||

|
Vene-tuoli[12] | ||

|
Kierre tuoli-tuoli[12] | ||
|
Kierre-vene-tuoli[12] |
Termistö
[muokkaa | muokkaa wikitekstiä]Kiertokulma
[muokkaa | muokkaa wikitekstiä]Yksittäisille kierto- eli dihedraalikulmille voidaan antaa nimiä ja etuliitteitä esimerkiksi rotameerien nimeämiseksi. Kulmat nimetään tiettyjen substituenttien eli atomi/atomiryhmien välisten kulmien mukaan.[1] Esimerkiksi butaanissa substituentit ovat metyylit (-CH3).
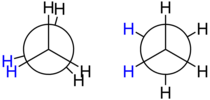
Molekyyleissä kuten etaani, joissa ryhmät ovat samoja, kutsutaan muotoja kohdakkaiseksi (engl. eclipsed) ja lomittaiseksi eli gauche-muodoksi.[1]
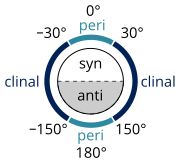
IUPAC:n mukaan, kun kiertokulma kahden substituentin välillä on[1]
- 0° ja ±90°, konformaatio on syn (s).
- ±90° ja 180°, konformaatio on anti (a).
- 30° and 150°, konformaatio on klinaali (c).
- 0° ja ±30° tai ±150° ja 180°, konformaatio on periplanaari (p).
Edeltävät voidaan yhdistää eli kun kiertokulma on välillä[1]
- 0° ja ±30°, konformaatio on synperiplanaari (sp) eli syn- tai cis-.
- 30° ja 90° tai –30° ja –90°, konformaatio on synklinaali (sc) eli gauche.
- 90° ja 150° tai –90° ja –150°, konformaatio on antiklinaali (ac).
- ±150° ja 180°, konformaatio on antiperiplanaari (ap) eli anti- tai trans-.
Molekyyli käännetään kuvitteellisesti siten, että kiertyvä sidos kohtisuoraan poispäin katsojasta. Konformaatioille voidaan käyttää etuliitteitä ap, sp, +sc, –sc, +ac ja –ac (kirjoitetaan kursiivilla) ja makromolekyyleille vastaavasti etuliitteitä T, C, G+, G-, A+ ja A- (ei-kursiivilla). Jos takimmainen substituentti on kiertynyt katsojaa lähempänä olevasta substituentista myötäpäivään alle 150°, saa konformaatio positiivisen etuliitteen (+sc tai +ac). Jos kierto on vastapäivään alle 150°, etuliite on negatiivinen (–sc tai –ac).[1]
Aksiaalisuus ja ekvatoriaalisuus
[muokkaa | muokkaa wikitekstiä]
Sykloheksaanissa enemmän pystysuuntaiset substituentit ovat aksiaalisia ja enemmän renkaan rungon tasossa olevat ovat ekvatoriaalisia. Käsitettä käytetään myös muissa rengasrakenteissa, kuten syklobutaanissa, syklo-oktaanissa jne. Joissain tilanteissa käytetään myös termejä pseudoaksiaalinen ja -ekvatoriaalinen.[1]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h i j k l m n o p q r s t u v w G. P. Moss: Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry, 1.1.1996, 68. vsk, nro 12, s. 2193–2222. doi:10.1351/pac199668122193 ISSN 1365-3075 Artikkelin verkkoversio.
- ↑ a b c d e f g h i j k l m J. Clayden, N. Greeves & S. Warren: Organic chemistry, s. 364–376, 827. (2. painos) Oxford: University Press, 2001. OCLC: 867050415 ISBN 9780199270293
- ↑ a b c d e J McMurry: Organic chemistry, s. 95–98, 118–120. Brooks/Cole, 2012. OCLC: 701208906 ISBN 9780840054449
- ↑ a b A. H. J. Engwerda ym.: Solid Phase Deracemization of an Atropisomer. Crystal Growth & Design, 25.9.2017, 17. vsk, nro 10, s. 5583–5585. PubMed:29018306 doi:10.1021/acs.cgd.7b01180 ISSN 1528-7483 Artikkelin verkkoversio.
- ↑ DL Nelson & MM Cox: Lehninger principles of biochemistry, s. 140. (5. painos) New York: W.H. Freeman, 2008. OCLC: 191854286. LCCN: 2007941224 ISBN 9780716771081 Teoksen verkkoversio.
- ↑ P. J. Canfield ym.: A new fundamental type of conformational isomerism. Nature Chemistry, 21.5.2018, 10. vsk, nro 6, s. 615–624. doi:10.1038/s41557-018-0043-6 ISSN 1755-4330 Artikkelin verkkoversio.
- ↑ Katrina Krämer: First new form of isomerism discovered in 50 years will be the last Chemistry World. 22.5.2018. Arkistoitu 22.5.2018. Viitattu 16.9.2018.
- ↑ L. Song ym.: Steric Strain versus Hyperconjugative Stabilization in Ethane Congeners. The Journal of Physical Chemistry A, 2005, 109. vsk, nro 10, s. 2310–2316. doi:10.1021/jp044700s ISSN 1089-5639 Artikkelin verkkoversio.
- ↑ C. W. Bock, P. George & M. Trachtman: A molecular orbital study of the rotation about the C-C bond in 1,3-butadiene. Theoretica Chimica Acta, 1984, 64. vsk, nro 4, s. 293–311. doi:10.1007/bf00551014 ISSN 0040-5744 Artikkelin verkkoversio.
- ↑ a b c d e f g h V. Dragojlovic: Conformational analysis of cycloalkanes. ChemTexts, 12.8.2015, 1. vsk, nro 3. doi:10.1007/s40828-015-0014-0 ISSN 2199-3793 Artikkelin verkkoversio.
- ↑ a b D. F. Bocian, H. M. Pickett, T. C. Rounds & H. L. Strauss: Conformations of cycloheptane. Journal of the American Chemical Society, helmikuu 1975, 97. vsk, nro 4, s. 687–695. doi:10.1021/ja00837a001 ISSN 0002-7863 Artikkelin verkkoversio.
- ↑ a b c d e P. W. Pakes, T. C. Rounds & H. L. Strauss: Conformations of cyclooctane and some related oxocanes. The Journal of Physical Chemistry, elokuu 1981, 85. vsk, nro 17, s. 2469–2475. doi:10.1021/j150617a013 ISSN 0022-3654 Artikkelin verkkoversio.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Conformational analysis of cycloalkanes - kattava katsaus rengasrakenteiden ja osin rotameerien konformaatioihin. (englanniksi)