Alfa-kierre
| Tähän artikkeliin tai sen osaan on merkitty lähteitä, mutta niihin ei viitata. Älä poista mallinetta ennen kuin viitteet on lisätty. Voit auttaa Wikipediaa lisäämällä artikkelille asianmukaisia viitteitä. Lähteettömät tiedot voidaan kyseenalaistaa tai poistaa. |

Alfa-kierre (α-kierre) eli alfa-heliksi (α-heliksi) on proteiinin rakenteessa sekundaarirakenne. Se on β-levyjen eli β-laskosten ohella proteiinien tärkein sekundaarirakenne. α-kierre on sauvamainen, vain yhdestä polypeptidiketjusta koostuva, proteiinin rakenneosa ja se on proteiinin kierrerakenteista vakain.
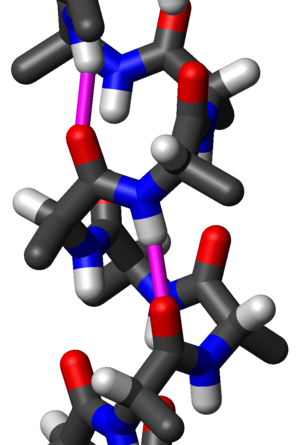
Alaniiniaminohapoista koostuvan α-kierteen tikkurakennemalli sivusta päin. Kaksi saman peptidiryhmän vetysidosta on korostettu magentalla; hapen ja vedyn välinen etäisyys on 2,08 Å. Polypeptidiketju kulkee tässä ylöspäin eli sen N-terminaali on alhaalla ja C-terminaali ylhäällä. Alaniinin metyylisivuketjut osoittavat lievästi alaspäin eli kohti N-terminaalia.
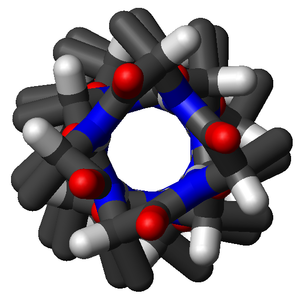
Sama polyalaniinin alfa-kierre kuin yläpuolisessa kuvassa. Neljä karbonyyliryhmää osoittavat kohti katsojaa. Ne ovat noin 100° erillään toisistaan eli aminohappotähdettä kohden alfa-kierre kiertyy 100°. Yhteen täyteen kierrokseen (360°) alfa-kierteessä tarvitaan 3,6 aminohappotähdettä.
Rakenne
[muokkaa | muokkaa wikitekstiä]α-kierrettä vakauttavat yksittäisen polypeptidiketjun sisäiset vetysidokset. N-terminaalista laskettuna kunkin aminohappotähteen α-hiilen viereisen karbonyylihiilen (CO) happiatomi muodostaa vetysidoksen siitä neljä aminohappotähdettä C-terminaalia kohti olevan aminohappotähteen α-hiilen viereisen aminoryhmän (NH) vetyatomin kanssa. Eli vetysidoksen muodostavien aminohappotähteiden väliin jää kolme aminohappotähdettä. α-kierteen kierteinen rakenne mahdollistaa vetysidoksiin osallistuvien atomien lineaarisen järjestyksen, mikä tekee kierteisestä konformaatiosta hyvin vakaan. Kussakin kierteessä on 3,6 aminohappotähdettä ja kierteen pituus on 5,4 Å eli 0,54 nm. Aminohappojen sivuketjut suuntautuvat kierteen akselilta ulospäin muodostaen kierteen ulkoreunat. Kierteen sisäosassa ei puolestaan ole yhtään vapaata tilaa, koska se on polypeptidirungon atomien täyttämä. Ulkoreunojen sivuketjut voivat olla hydrofiilisiä eli vesihakuisia, hydrofobisia eli vettä hylkiviä tai amfipaattisia eli molempia edellä mainituista. Amfipaattisessa α-kierteessä toinen puoli voi olla hydrofiilinen ja toinen puoli hydrofobinen.
Osuus proteiinissa ja kierteen katkeaminen
[muokkaa | muokkaa wikitekstiä]Proteiineilla on vaihtelevia määriä alfa-kierteitä rakenteissaan. Alfa-kierteiden osuus voi vaihdella muutamasta prosentista lähes sataan prosenttiin. Useat tekijät voivat katkaista alfa-kierrerakenteen: 1) Syklinen aminohappo proliini muodostaa mutkan kierrerakenteeseen. Proliini ei kykene jatkamaan kierrerakennetta, koska sen α-hiilen ja sen viereisen α-aminoryhmän välisen sidoksen kiertyminen on erittäin rajoittunut ja α-aminoryhmä ei kykene osallistumaan polypeptidiketjun sisäisten rakennetta vakauttavien vetysidosten muodostamiseen. 2) Samanmerkkisen sähkövarauksen omaavien aminohappotähdeiden sivuketjujen läheisyys aiheuttaa elektrostaattista hylkimistä, joka estää kierrerakenteen jatkumista. Positiivisesti varautuneita toisiaan hylkiviä sivuketjuja on esimerkiksi arginiinin ja lysiinin välillä. Negatiivisesti varautuneita toisiaan hylkiviä sivuketjuja on esimerkiksi glutamiini- ja asparagiinihappojen välillä. 3) Toistensa lähellä sijaitsevien laajan sivuketjun omaavien aminohappotähteiden välinen steerinen hyljintä voi myös katkaista alfa-kierteen, koska laajoille sivuketjuille ei ole riittävästi tilaa sauvamaisessa rakenteessa. Esimerkiksi valiini ja treoniini voivat aiheuttaa steerisiä ongelmia, koska niiden sivuketjujen β-hiiliin on kiinnittynyt α-hiilen lisäksi kaksi muuta isompaa atomia ja vain yksi vety.
α-kierre ja aminohappojärjestys
[muokkaa | muokkaa wikitekstiä]α-kierteessä esiintyy usein muun muassa alaniinia, leusiinia, lysiiniä, varautumatonta glutamiinihappoa ja metioniinia. Näiden aminohappojen lyhennekirjaimista muodostuu muistisäännöksi sana MALEK. α-kierteeseen ei sovi esimerkiksi proliini, glysiini ja negatiivisesti varautunut aspartaanihappo.
Eräässä proteiinissa näkyy seuraava kuvio, jos aminohapot pannaan α-kierteen mukaiseen järjestykseen:[1]
ile arg gly thr gly ser tyr asn arg ser ser phe glu ser ser ser gly leu val try
Lähteet
[muokkaa | muokkaa wikitekstiä]- Campbell, M. K. et al.: Biochemistry, Part II: The three-dimensional structure of proteins, s. 307. (2. painos) USA: Saunders College Publishing, 1991. ISBN 0-03-001872-2 (englanniksi)
- Heino, J. & Vuento, M.: ”Biomolekyylit”, Biokemian ja solubiologian perusteet. (1. painos) WSOY Oppimateriaalit, 2007. ISBN 978-951-0-32563-6
Viitteet
[muokkaa | muokkaa wikitekstiä]- ↑ Bogen, Hans Joachim: Tieto-Arena: Biologia, s. 307. (Knaurs Buch der modernen Biologie) Suomentanut Anto Laikola. Helsinki: Kirjayhtymä, 1968.
